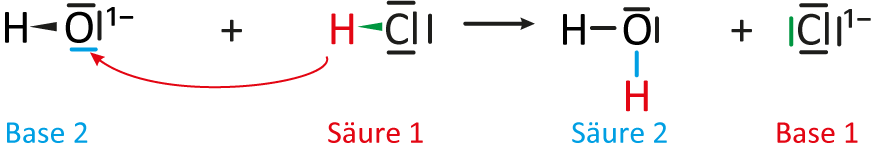Säure-Base-Reaktionen (=Protolyse-Reaktionen)
1 Reaktion von Chlorwasserstoffgas mit festem Natriumhydroxid
2 Reaktion von Chlorwasserstoff-Gas mit Ammoniak-Gas
3 Reaktion von festem Ammoniumchlorid und festem Natriumhydroxid
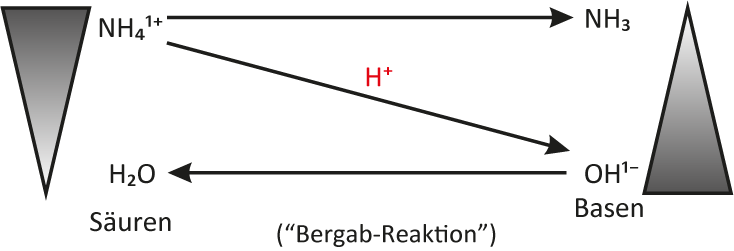
4 Allgemeine Säure-Base-Definition nach Brønsted (1923)
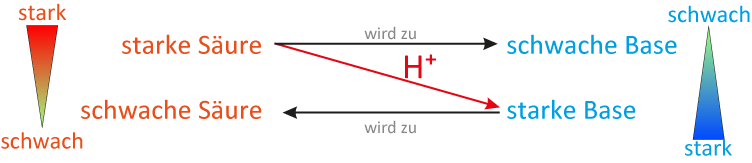
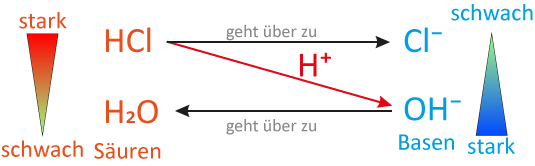
5 Stärke von Säuren und Basen
6 Chlorwasserstoff-Gas und Wasser (Springbrunnen)
7 Konzentration
8 Neutralisationsreaktion
9 Reaktion von verdünnter Salzsäure mit verdünnter Natronlauge
10 Reaktion von Calciumoxid mit Wasser
(x) Ammoniak-Gas + Wasser (Springbrunnen 2)
11 Technisch wichtige Säuren
11.1 Schwefelsäure
11.2 Schweflige Säure
- Details
- Geschrieben von: Wolfram Hölzel
Säure-Base-Reaktionen (=Protolyse-Reaktionen)
In diesem Kapitel geht es um die zweite Möglichkeit, wie eine chemische Reaktion ablaufen kann. Dabei werden zunächst einige typische Beispiele betrachtet. Danach wird die Definition (die bis dahin sowieso wohl schon vielen klar sein wird) aufgestellt.
1 Reaktion von Chlorwasserstoffgas mit festem Natriumhydroxid
Hinweis: Um die Vorgänge besser nachvollziehen zu können gibt es hier ein Periodensystem der Elemente-Popup
Ausgangsstoffe:
| Name | Summenformel | Strukturformel | Bindung |
| Chlorwasserstoff | HCl | Polare Atombindung | |
| Natriumhydroxid | NaOH | |
Ionenbindung |
a) Versuch:

b) Beobachtung:
Natriumhydroxid überzieht sich mit einem weißen Feststoff; am Ende des Glasrohres schlägt sich eine farblose Flüssigkeit nieder, das Reaktionsrohr erwärmt sich.
c) Auswertung: Folgende Teilchen reagieren miteinander:
I Teilchengleichung:
Na¹⁺OH¹⁻ + HCl → H₂O + Na¹⁺Cl¹⁻
NaOH(s) + HCl(g) → H₂O(l) + NaCl(s) ΔH < 0
d) Protolyse-Schema
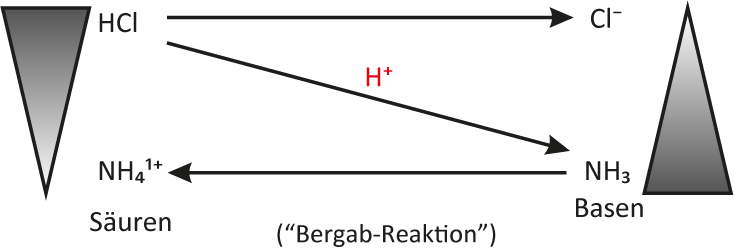
Allgemeines Protolyse-Schema
Ein Protolyse-Schema funktioniert analog zum Redox-Schema (siehe vorheriges Kapitel). Hier zunächst ein allgemeines Schema (welches für alle Säure-Base-Reaktion so gelten kann):
Protolyse-Sschema für die Bildung von Natriumchlorid
e) Erklärung der exothermen Reaktion
| ΔH > 0 (positiv, endotherm) | ΔH < 0 (negativ, exotherm) |
|
|
Ergebnis: ΔH < 0 (negativ, exotherm) überwiegt.
- Details
- Geschrieben von: Wolfram Hölzel
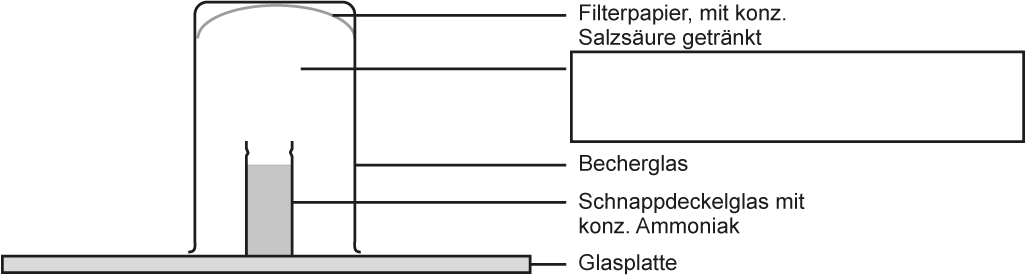
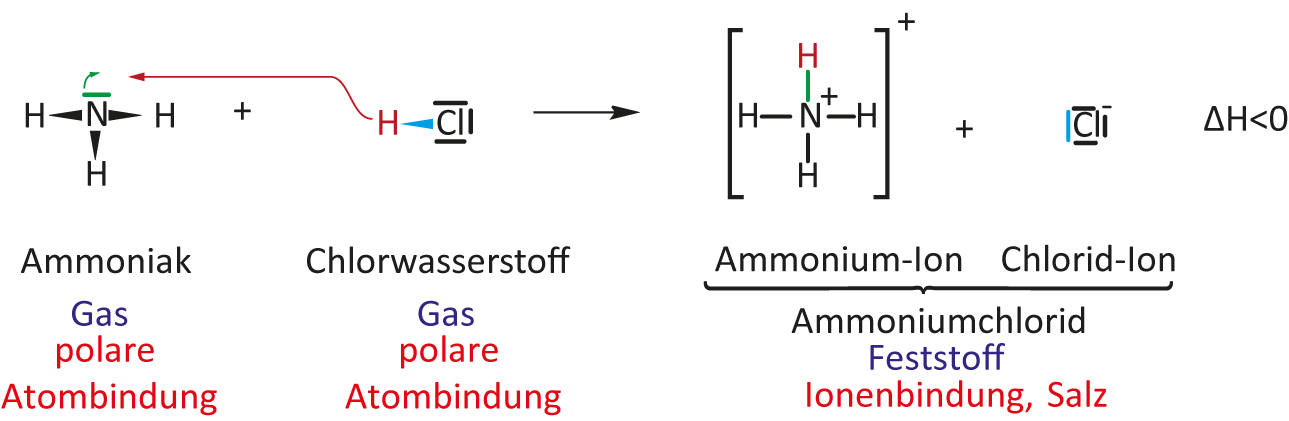
2 Reaktion von Chlorwasserstoff-Gas mit Ammoniak-Gas
Hinweis: Um die Vorgänge besser nachvollziehen zu können gibt es hier ein Periodensystem der Elemente-Popup
Bei diesen zwei Teilchen liegen polare Atombindungen vor:
a) Versuch mit Skizze: (vgl. AB )
b) Beobachtung:
Innerhalb des Becherglas bildet sich weißer Rauch. Am Boden der Glasplatte setzt sich ein weißer, kristalliner Stoff ab.
Vorher:
Nachher:
c) Auswertung:
I. Teilchengleichung:
NH₃ + HCl → NH₄¹⁺Cl¹⁻
II. Reaktionsgleichung (Stoffgleichung)
NH₃ (g) + HCl (g) → NH₄Cl (s) ΔH < 0
III. Protolyse-Schema
Aufgabe: Skizziert einmal das Protolyse-Schema für diese chemische Reaktion. Tipp: Falls Ihr noch Schwierigkeiten damit habt, schaut nochmal das allgemeine Beispiel an.
{slider title="Lösung: Protolyse-Schema für die Bildung von Ammoniumchlorid" open="false" class="icon"}
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
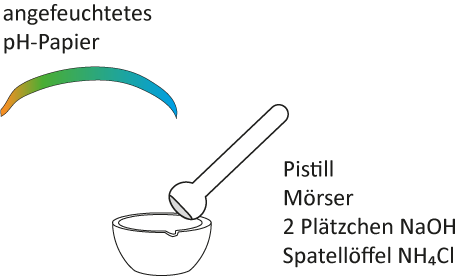
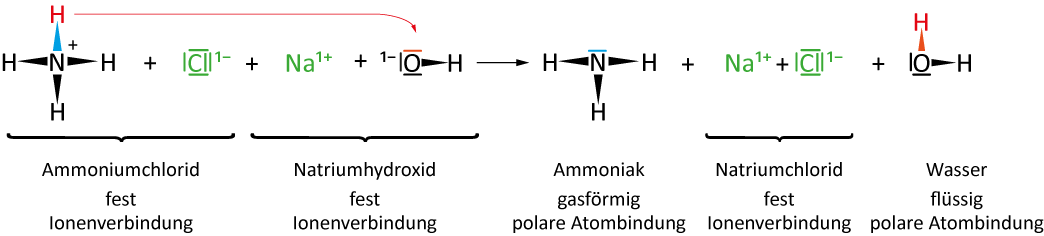
3 Reaktion von festem Ammoniumchlorid und festem Natriumhydroxid
a) Versuch mit Skizze
Die beiden Salze NH₄Cl und NaOH werden gemeinsam im Mörser zerrieben. Nach dem Zerreiben wird ein angefeuchtetes Indikatorpapier über die Schale gehalten; zusätzlich wird eine Geruchsprobe vorgenommen.
b) Beobachtung:
Es entsteht ein stechend riechendes Gas. Das feuchte Indikatorpapier färbt sich blau. Die Festsubstanz im Mörser wird feucht.
c) Auswertung:
I. Teilchengleichung
II. Reaktionsgleichung
| NH₄Cl | + | NaOH | → | NH₃ | + | NaCl | + | H₂O |
| Ammoniumchlorid | Natriumhydroxid | Ammoniak | Natriumchlorid | Wasser |
III. Protolysenschema
Aufgabe: Formuliert für diese chemische Reaktion ein Protolyse-Schema
{slider title="Lösung: Protolyse-Schema für das Verreiben von Ammoniumchlorid und Natriumhydroxid" open="false" class="icon"}
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
4 Allgemeine Säure-Base-Definition nach Brønsted (1923)
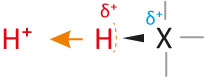
a) Säuren...
... sind Teilchen, die Protonen abgeben können (= Protonendonator, „Protonenspender“).
Die Teilchen enthalten positivierte H-Atome (Die Bindung zum H-Atom muss polar sein):
Wasserstoffatome bestehen nur aus Protonen und Elektronen. Eine Säure besitzt ein Wasserstoffatom, wobei das Elektron von dem Wasserstoffatom „stark“ angezogen wird. Kommt es zu einer Säure-Base-Reaktion (Protolyse), dann wird vereinfacht ausgedrückt nur das Proton des Wasserstoffatoms abgegeben. Das Elektron der Wasserstoffatoms bleibt beim Teilchen zurück (vgl. dazu alle vorher genannten Beispiele).
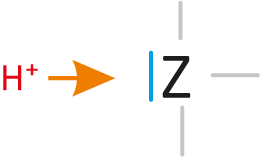
b) Basen...
sind Teilchen, die Protonen aufnehmen können (= Protonenakzeptor, „Protonenräuber“). Die Teilchen enthalten mindestens ein freies Elektronenpaar.
Dieses freie Elektronenpaar „nimmt“ dann den positiven Wasserstoffkern (Proton) „auf“.
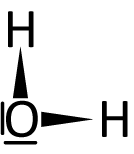
c) Übung
Im folgenden ist die Lewis-Formel (Strukturformel) von Wasser abgebildet. Gehört dieses Molekül zu einer Brønsted-Säure oder -Base? Schaut Euch dafür nochmals die Definitionen an.
{slider title="Lösung: Was ist Wasser? Eine Säure oder Base?" open="false" class="icon"}
Wasser kann (je nach Reaktionspartner) beides sein. Es kann ein Proton (H⁺) abgeben [es hat ja positivierte Wasserstoff-Atome], wie auch aufnehmen [es hat ja auch freie Elektronenpaare].
Dafür gibt es eine neue Bezeichnung: Wasser ist ein Ampholyt.
{/sliders}
c) Ampholyte
Ampholyte können sowohl als Säuren, wie auch als Basen reagieren. Sie müssen also freie Elektronenpaare (für die Funktion als Basen) wie auch positivierte Wasserstoff-Atome (Funktion als Säure) besitzen.
- Details
- Geschrieben von: Wolfram Hölzel