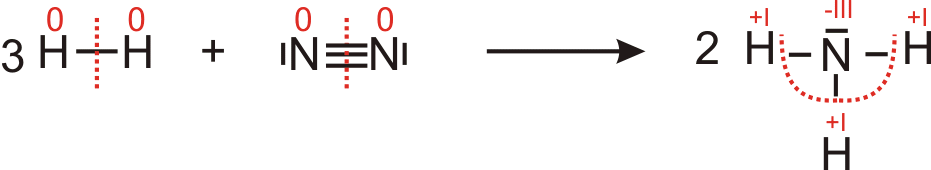3 Redoxreaktionen mit Molekülen
Bei der Verbrennung von Stoffen bilden sich Oxide, ohne dass es zur Bildung von Ionen kommt. Beispiele dafür sind die Verbrennung von Wasserstoff, Kohlenstoff, Schwefel und Phosphor.
Um diese Reaktion als Redoxreaktion erfassen zu können, hat man als Hilfsgröße die Oxidationszahl eingeführt.
3.1 Oxidationszahl
Def.: Die Oxidationszahl gibt an, welche Ladung ein Atom in einem Molekül oder in einem anderen Teilchen hätte, wenn alle am Aufbau des Teilchens beteiligten Atome in Form von Ionen vorlägen.
Die sich für die Atome in der Verbindung ergebenden formalen Ladungszahlen nennt man Oxidationszahlen. Zur Unterscheidung von Ionenladungen werden sie als römische Zahlen an die Elementsymbole geschrieben.
|
Vorgehensweise: Vgl. dazu die zwei Beispiele 3.2 und 3.3 um die Schritte nachvollziehen zu können. 1. Schritt: Strukturformel erstellen. Faustregel: (Hinweis: Wann immer eindeutige Strukturformeln möglich sind, würde ich keine Faustregeln nutzen)
4. Schritt: Man bestimmt die Hauptgruppennummer des Elements und zählt dann die Elektronen, welche das Element jetzt "formal" hätte (vgl. 3. Schritt). Dann berechnet man entsprechend folgender Formel: Oxidationszahl = Hauptgruppennummer des Elements – Elektronenanzahl im Molekül Bsp. Sauerstoff im Wassermolekül: Oxidationszahl(O) = steht in der 6. Hauptgruppe = VI - 8 = -2 (bzw. - II)
|
Mit Hilfe der Oxidationszahl lassen sich die Begriffe Oxidation und Reduktion neu fassen:
Oxidation: Elektronenabgabe) bedeutet eine Erhöhung der Oxidationszahl.
Reduktion: (Elektronenaufnahme) bedeutet eine Erniedrigung der Oxidationszahl.
Redoxreaktionen: sind Vorgänge bei denen sich die Oxidationszahlen der beteiligten Atomarten ändern.
3.2 Vollständige Verbrennung von Kohlenstoff
Kohlenstoff Sauerstoff Kohlenstoff(IV)-oxid
Atom Molekül Molekül
![]()
→ Kohlenstoff wird oxidiert, Sauerstoff wird reduziert.
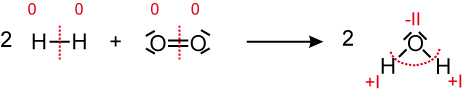
3.3 Reaktion von Wasserstoff mit Sauerstoff
Wasserstoff Sauerstoff Wasser
Oxidationszahlen von Wasserstoff wird positiver → Wasserstoff wird oxidiert
Oxidationszahlen von Sauerstoff wird negativer → Sauerstoff wird reduziert
3.5 Reaktion von Wasserstoff mit Stickstoff zu Ammoniak (Ammoniaksynthese)
Oxidationszahlen von Wasserstoff wird positiver → Wasserstoff wurde oxidiert
Oxidationszahlen von Stickestoff wurde negativer → Stickstoff wurde reduziert
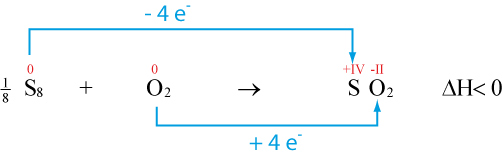
3.6 Reaktion von Schwefel mit Sauerstoff zu Schwefeldioxid
Man muss nicht immer die Lewis-Formeln (Strukturformeln) zeichnen. Manchmal genügt es, nach den Faustregeln zu arbeiten.
Oxidationszahlen von Schwefel wird positiver → Schwefel wurde oxidiert
Oxidationszahlen von Sauerstoff wurde negativer → Sauerstoff wurde reduziert
3.7 Synthese von Chlorwasserstoff aus den Elementen
Oxidationszahlen von Wasserstoff wird positiver → Wasserstoff wurde oxidiert
Oxidationszahlen von Chor wurde negativer → Chlor wurde reduziert
3.8 Synthese von Schwefelwasserstoff aus den Elementen
Oxidationszahlen von Wasserstoff wird positiver → Wasserstoff wurde oxidiert
Oxidationszahlen von Schwefel wurde negativer → Schwefel wurde reduziert