11 Entropie – S
Die Entropie S kann als Maß für die Unordnung eines Systems interpretiert werden. Die Entropie ist ein direktes und quantitatives Maß für die Unordnung.
Beispiel: Spontane physikalische Vorgänge (Diffusion zweier Gase)
Versuch:
Durchmischung von Bromdämpfen. 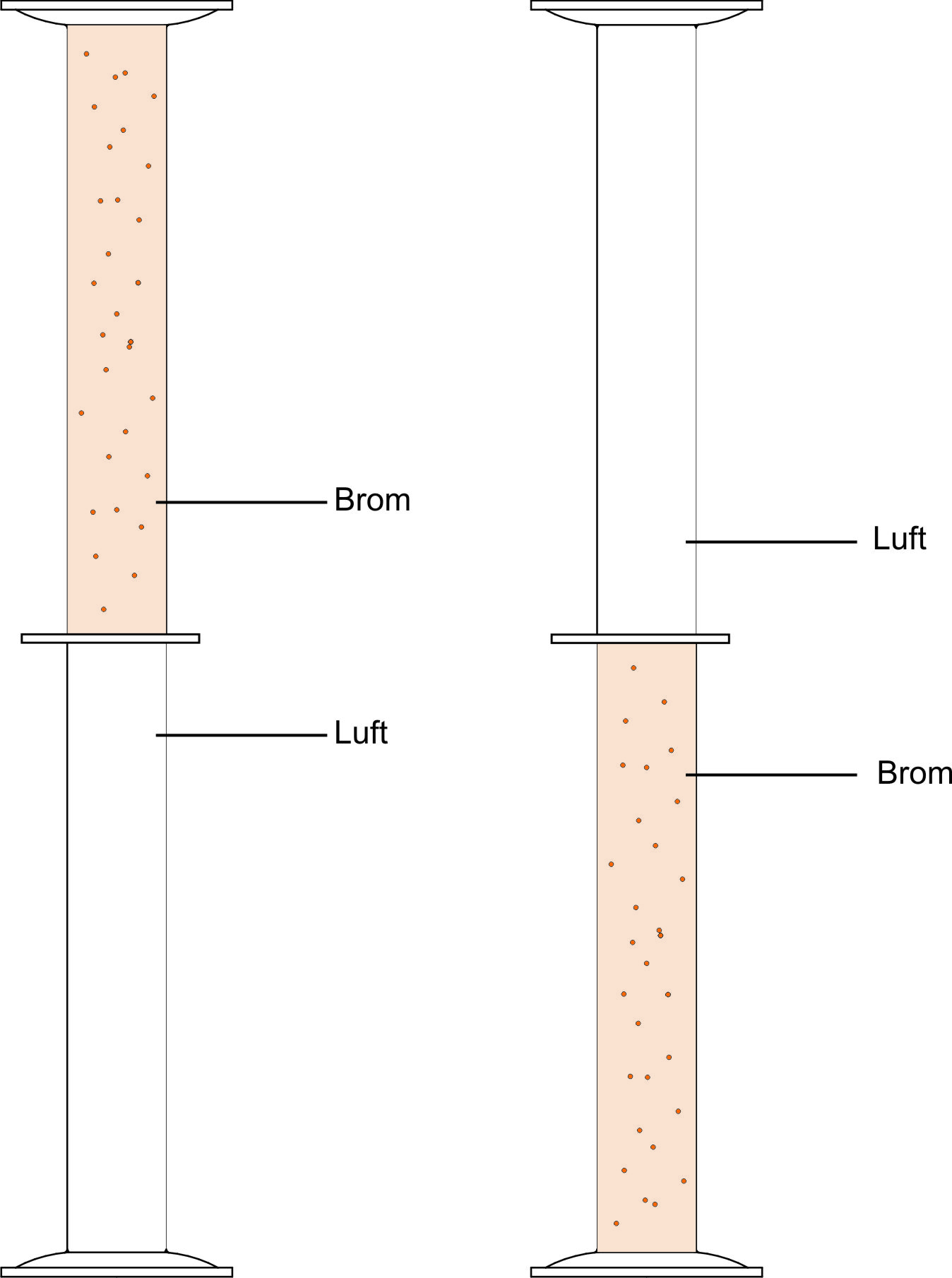
Ergebnis: Nach Entfernung der Sperre haben sich nach einiger Zeit die Gase vollständige durchmischt.
Folgerung: Die Wahrscheinlichkeit ein Brom-Molekül im Ausgangszylinder zu finden, ist kleiner geworden. Der „Ordnungsgrad“ ist somit nach dem Durchmischen geringer, die „Unordnung“ größer.
Merke:
Ein ungeordneter Zustand ist statistisch gesehen von einer höheren Wahrscheinlichkeit als ein geordneter.
Die Energie ist offenbar nicht der einzige Faktor, der bestimmt, ob eine chemische Reaktion spontan abläuft. Ein weiterer Faktor spielt bei spontanen Reaktionen noch eine entscheidende Rolle und zwar die erzeugte Unordnung.
Spontane Reaktionen haben Neigung, in Richtung niederer Energie abzulaufen, aber sie haben ebenso die Neigung, in Richtung größere Unordnung abzulaufen.
Merke:
- Die Gesamtenergie des Universums ist konstant.
- Die Gesamtentropie des Universums nimmt stets zu.
3. Hauptsatz der Thermodynamik: Für einen aus gleichen Atomen bestehenden, ideal gewachsenen Kristall ist beim absoluten Nullpunkt T = 0 K (-273 °C) die Entropie null.
11.1 Zunahme der Entropie („Faustregeln“)
- Die Entropie (oder Unordnung) nimmt immer dann zu, wenn eine Flüssigkeit oder ein Festkörper in ein Gas verwandelt werden.
- Die Entropie nimmt zu, wenn ein Festkörper oder eine Flüssigkeit in Wasser gelöst werden.
- Die Entropie nimmt zu, wenn die Anzahl der unabhängig voneinander beweglichen Teilchen zunimmt.
- Die Entropie nimmt zu, wenn die mittlere Geschwindigkeit der Teilchen, also die Temperatur zunimmt.
Führt man einem System bei der Temperatur T die Wärme Q zu, so erhöht sich die Entropie um:
ΔS = Q/T
Deutung: Die Zufuhr einer bestimmten Wärme Q führt bei höherer Temperatur zu einer kleineren Entropiezunahme als bei niedrigerer Temperatur.
