2.3.1 Standardelektronenpotential von Kupfer
Versuch: Experimentelle Bestimmung des Normalpotentials des Cu (Hinweis: Anstatt einem Becherglas geht natürlich auch ein U-Rohr)
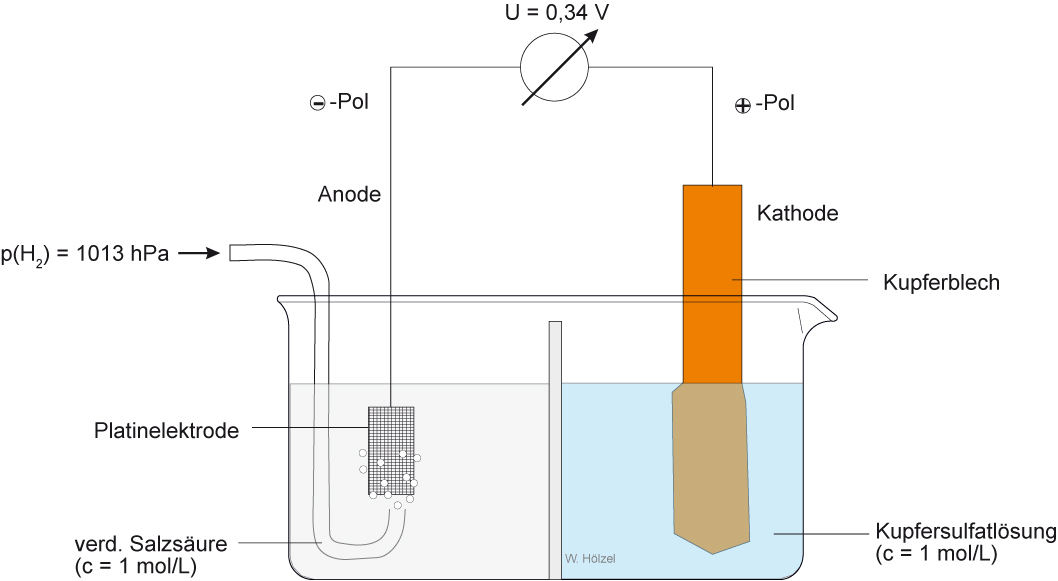
Zellendiagramm: [Pt] H₂/2 H⁺(c = 1 mol/L) // Cu²⁺(c = 1 mol/L) / Cu
Elektrodenreaktionen (Halbzellenreaktionen)
Oxidation: - Pol: H₂ + 2 H₂O → 2 H₃O⁺ (aq) + 2 e⁻
Reduktion: + Pol: Cu²⁺(aq) + 2 e⁻ → Cu
-------------------------------------------------------------------------------------------------------------
Gesamte Zellenreaktion: H₂ (g)+ 2 H₂O(l) + Cu²⁺(aq) → 2 H₃O⁺(aq) + Cu (s)
