1 Autoprotolyse (Eigenprotolyse) des Wassers und pH-Wert
1.1 Das Ionenprodukt des Wassers
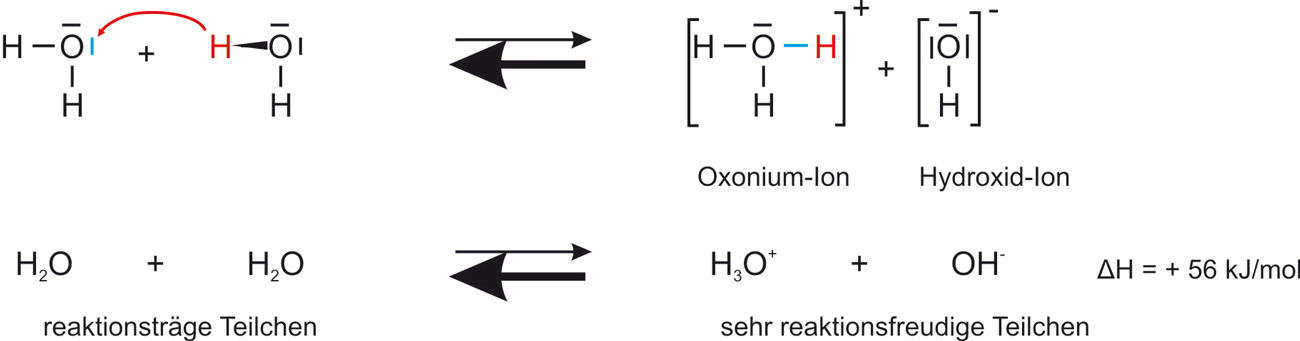
Destilliertes Wasser besitzt eine geringe Leitfähigkeit (Hinweis auf Ionen). Diese Ionen sind durch eine Protolyse-Reaktion entstanden.
Hinweis: Bei der Aufstellung des MWG steht das Oxonium-Ion in der Regel im Zähler.
![]()
Überlegungen:
• 1 mol Wasser hat die Masse 18,0 g
• 1 L (1000 ml) Wasser besitzt bei 25 °C die Masse 997 g;
Wie viel H₂O-Moleküle enthält 1 L Wasser?
Dichte: ![]()
![]()
Stoffmenge:
![]()
![]()
Konzentration:
![]()
![]()
(= 55,4 * 6,022*10²³ Wassermoleküle!)
Die H₂O -Konzentration in Wasser beträgt also 55,4 mol/l.
Z. B. durch Leitfähigkeitsmessung kann die Ionenkonzentration ermittelt werden: Bei 25°C:
![]()
Diese Werte in das MWG einsetzen:
![]()
Kc ist extrem klein, das GG liegt weitgehend auf der linken Seite ⇨ Die Konzentration von H₂O ist daher auch bei GG-Verschiebungen praktisch konstant; sie kann mit der GG-Konstanten K zu einer neuen Konstanten KW (Ionenprodukt des Wassers vereinigt werden)
K • c²(H₂O) = KW = c(H₃O⁺) • c(OH⁻) = 1,00 • 10-14 mol²/l²
Die Konstante KW ist das Ionenprodukt des Wassers:
KW= c(H₃O⁺) • c(OH⁻) = 1,00 • 10-14 mol²/l² bei 25 °C
![]() = c(H₃O⁺) = c(OH⁻) = (1,00 • 10-14 mol²/l²)½ = 1,00 • 10-7 mol/l
= c(H₃O⁺) = c(OH⁻) = (1,00 • 10-14 mol²/l²)½ = 1,00 • 10-7 mol/l
Achtung: In reinem Wasser und in neutralen wässrigen Lösungen beträgt die Konzentration der Hydroxonium-Ionen der der Hydroxid-Ionen: 10-7 mol/l.
Es haben also nur 2 Wasser-Moleküle von einer Milliarde zu einem Oxonium-Ion und eine Hydroxid-Ion reagiert.
- Details
- Geschrieben von: Wolfram Hölzel
2 Der pH-Wert
Um das Ionenprodukt übersichtlicher beschreiben zu können, führt man den pH-Wert (potentia hydrogenii), den pOH-Wert und den pKW-Wert ein.
Der pH-Wert ist der negative dekadische Logarithmus der Oxonium-Ionenkonzentration.
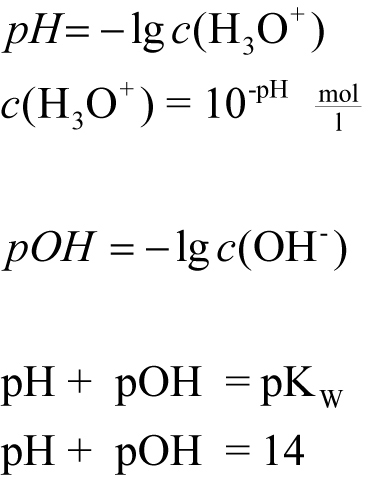
Folgende Werte gelten bei 25°C.
| c(H₃O⁺) | 10⁰ | 10⁻⁶ | 10⁻⁷ | 10⁻⁸ | 10⁻¹⁴ | mol/l |
| c(OH⁻) | 10⁻¹⁴ | 10⁻⁸ | 10⁻⁷ | 10⁻⁶ | 10⁰ | mol/l |
| pH | 0 | 6 | 7 | 8 | 14 | |
| pOH | 14 | 8 | 7 | 6 | 0 |
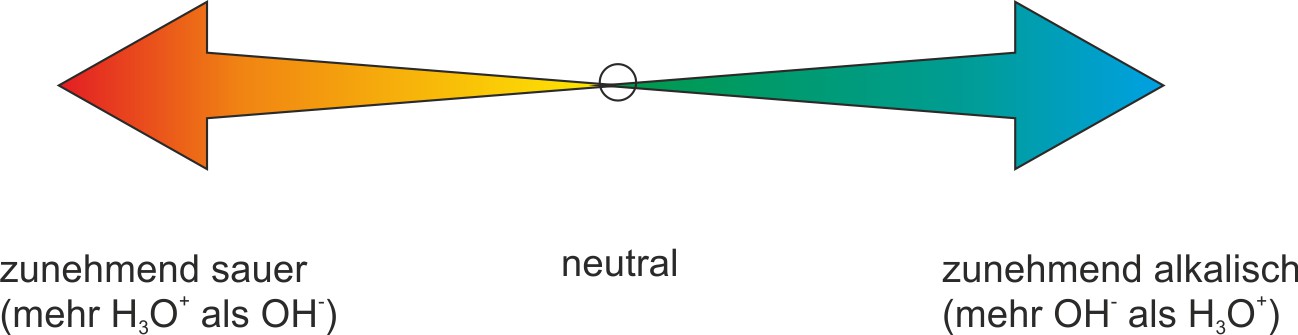
Zur Kennzeichnung, ob es sich um eine saure, neutrale oder alkalische Lösung handelt, reicht es vollständig aus, nur die Konzentration einer Ionensorte anzugeben (i.d.R. die Oxonium-Ionen-Konzentration).
Beispiel:
Aussage:
„pH = 2“: c(H₃O⁺) = 10⁻² mol/l = 0,01 mol/l
“pH = 12”: c(H₃O⁺) = 10⁻¹² mol/l = 0,000 000 000 001 mol/l
In einer sauren Lösung ist die c(H₃O⁺) > 10⁻⁷ mol/l ⇨ pH < 7
In einer alkalischen Lösung ist die c(OH⁻) > 10⁻⁷ mol/l ⇨ pH > 7
- Details
- Geschrieben von: Wolfram Hölzel
3 Protolyse-Reaktionen
3.1 Chlorwasserstoff-Gas und Wasser (Springbrunnen)
Chlorwasserstoff: Summenformel HCl, polare Atombindung, Gas, stechender Geruch 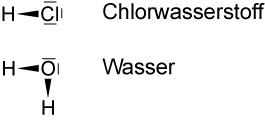
Wasser: Summenformel H₂O, polare Atombindung, Flüssigkeit, geruchslos
a) Versuch:
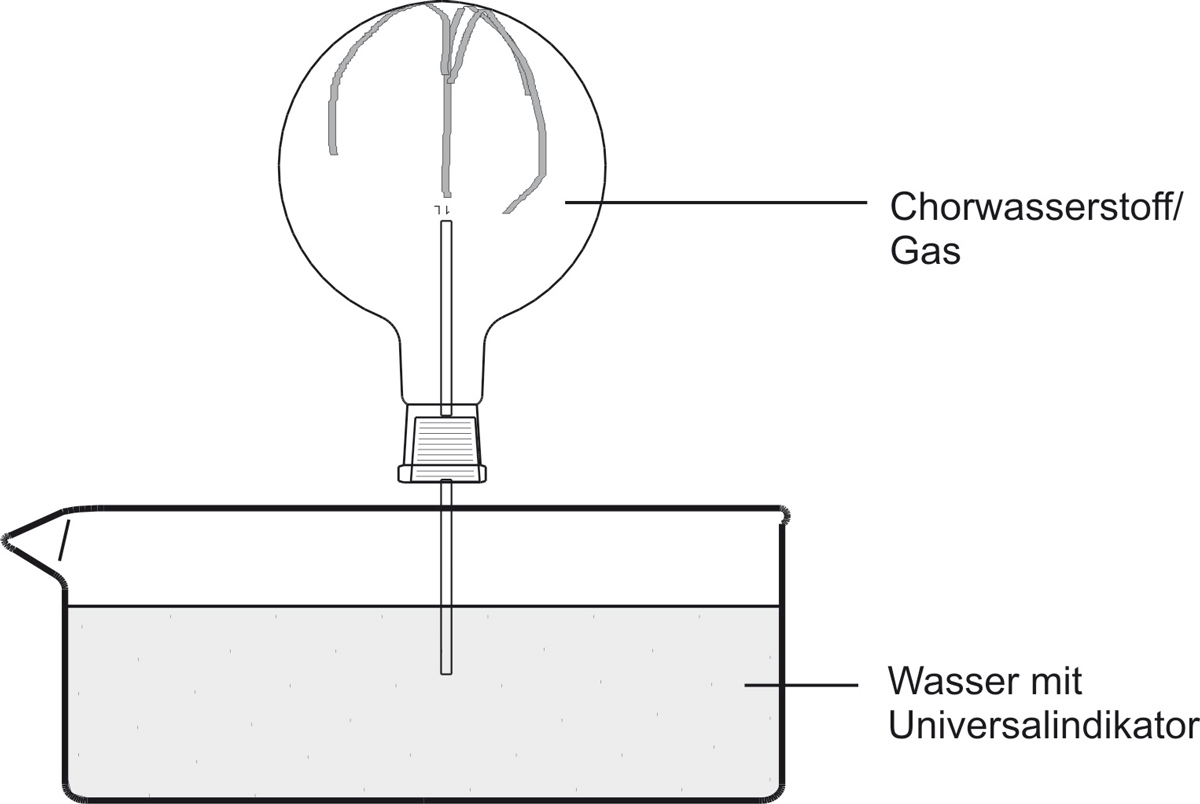
b) Beobachtung:
Das Wasser „schießt“ bergauf in den Rundkolben. Die Indikatorfarbe schlägt nach rot/gelb um. Die rote wässrige Lösung ist geruchlos.
c) Reaktionsgleichung – Struktur/Lewisformel:
Es gibt zwei mögliche Reaktionsgleichungen (wenn man zunächst die Säurestärke vernachlässigt). Welche zwei Reaktionsgleichungen sind das?
{slider title="Lösung" open="false" class="icon"}
1. Möglichkeit:
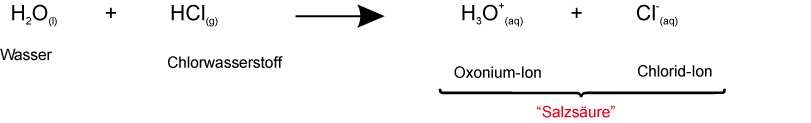
2. Möglichkeit:
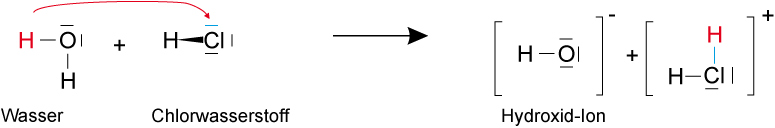
Chlorwasserstoff ist die stärkere Säure, Hydroxid-Ionen ist eine sehr starke Base (vgl später). Durch Elektrolyse wird die erste Möglichkeit bestätigt.
{/sliders}
Nachweis der gebildeten Ionen:
- Leitfähigkeitsmessung
- durch Elektrolyse: An der Anode (+-Pol) entsteht dabei Cl₂-Gas. Somit müssen in der verdünnten Salzsäure Chlorid-Ionen (Cl⁻-Ionen) vorliegen.

- durch Indikator: Die Gelbfärbung bei Bromthymolblau zeigt Oxonium-Ionen (H₃O⁺) an.
Komplette Lösung:
{slider title="Lösung" open="false" class="icon"}
Reaktionsgleichung
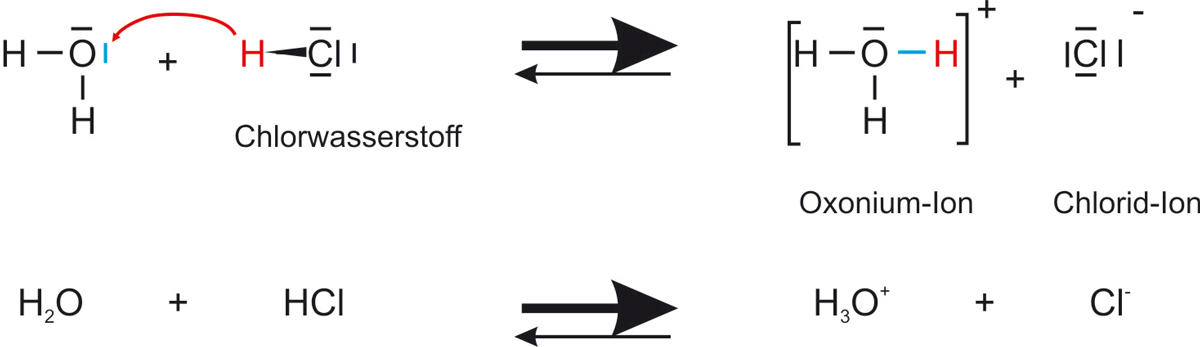

Verdünnte Salzsäure enthält hydratisierte Oxonium- und Chlorid-Ionen und Wassermoleküle.
d) Protolyseschema
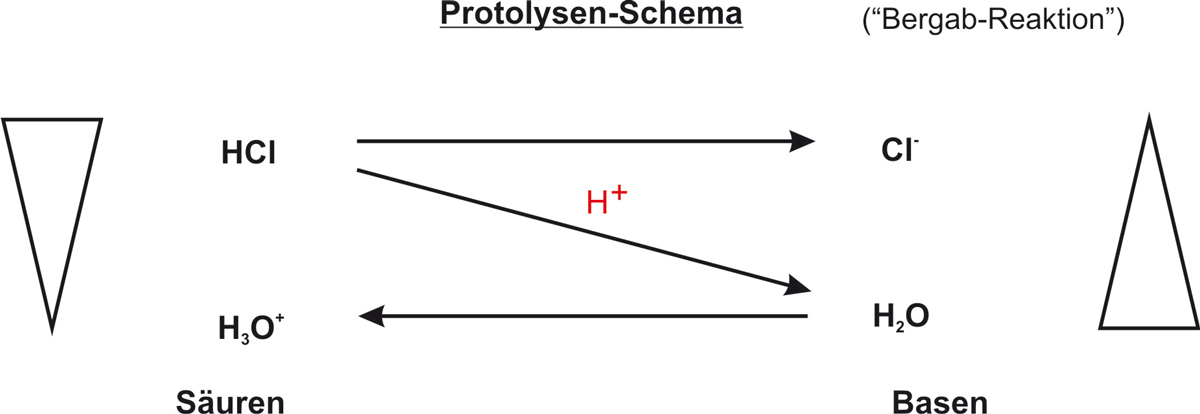
{/sliders}
e) Erklärung:
Chlorwasserstoff-Gas reagiert mit Wasser. Im Zylinder entsteht ein Unterdruck. Die Oxonium-Ionen färben den Universalindikator/Bromthymolblau rot/gelb.
Salzsäure = wässrige Lösung des Gases Chlorwasserstoff
Wenn man sehr viel HCl-Gas in Wasser einleitet, reagieren nicht mehr alle HCl-Moleküle mit den H₂O-Molekülen. Diese HCl-Moleküle liegen „gelöst“ vor. Es ist so „rauchende“ bzw. konzentrierte Salzsäure entstanden.
| Leitfähigkeit | Geruch | Indikatorpapier | Teilchen | |
| verdünnte Salzsäure | + | - | rot | H₂O, H₃O⁺, Cl⁻ |
| rauchende Salzsäure | + | + | rot | H₂O, H₃O⁺, Cl⁻, HCl |
- Details
- Geschrieben von: Wolfram Hölzel
3.2 Ammoniak-Gas + Wasser (Springbrunnen 2)
a) Versuch:
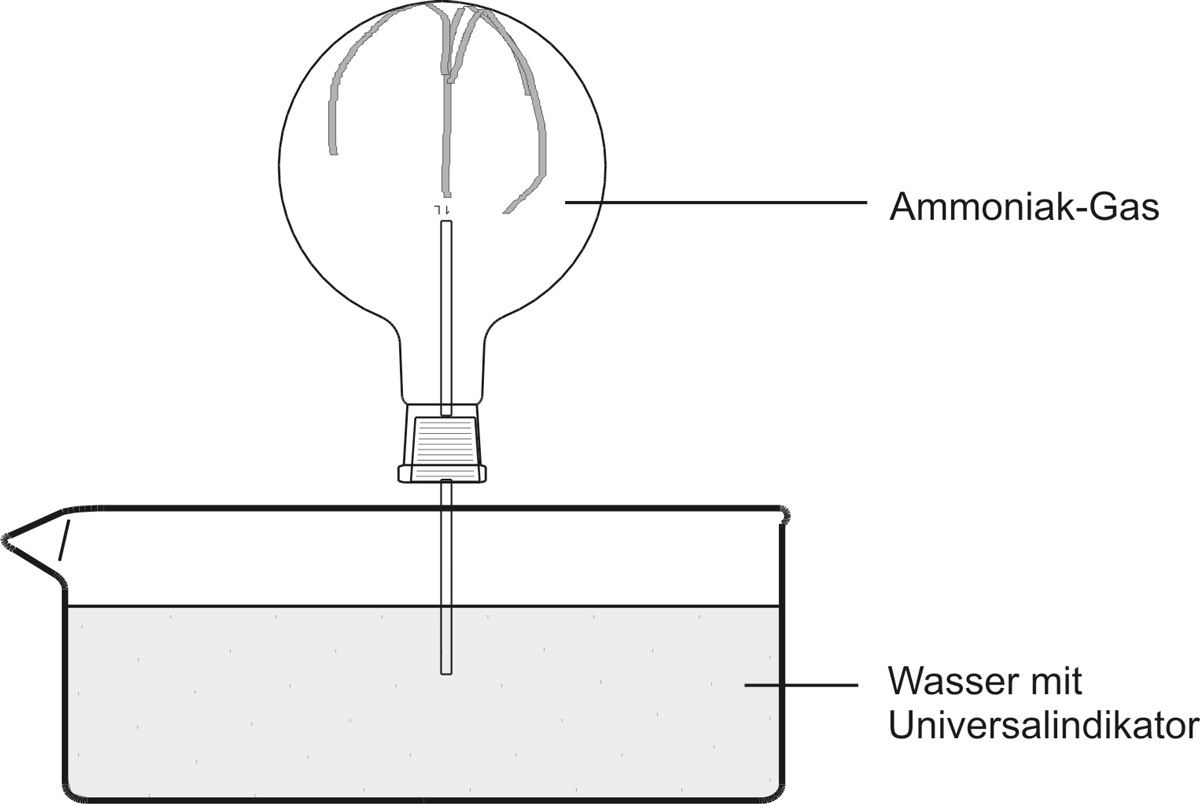
b) Beobachtung:
Das Wasser „schießt“ bergauf in den Rundkolben. Die Indikatorfarbe schlägt nach blau um. Die blaue wässrige Lösung riecht nach Ammoniak.
c) Erklärung:
Ammoniak-Gas löst sich sehr gut im Wasser und reagiert z.T. mit Wasser. Im Zylinder entsteht ein Unterdruck. Die Hydroxid-Ionen färben den Universalindikator blau.
d) Reaktionsgleichung (mit Strukturformeln und Summenformeln)
Versucht diese erst selber zu formulieren!
{slider title="Lösung" open="false" class="icon"}
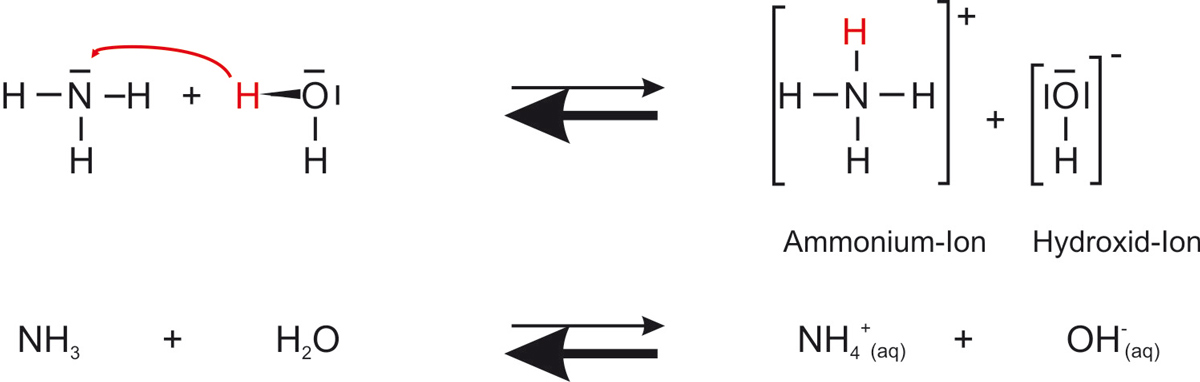
{/sliders}
Formuliert das Protolyseschema zu formulieren:
{slider title="Lösung" open="false" class="icon"}
e) Protolyseschema
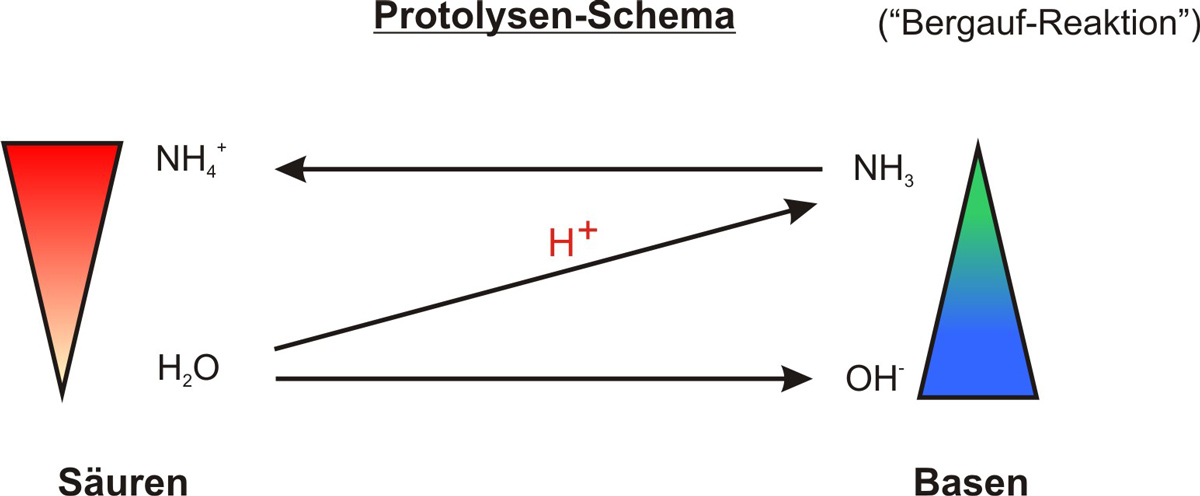
{/sliders}
Exkurs: Was macht den Sprudel sauer?
Sprudel: CO₂ (g) + H₂O (g) ⇌ “H₂CO₃" (aq) instabil, siehe Erlenmeyer-Regel
1. Protolysestufe: H₂CO₃ (aq) + H₂O (l) ⇌ HCO₃⁻ (aq) + H₃O⁺ (aq)
2. Protolysestufe: HCO₃⁻ (aq) + H₂O (l) ⇌ CO₃²⁻ (aq) + H₃O⁺ (aq)
Nachweis der H₃O⁺-Ionen durch?
a) Geschmack
b) pH-Papier
c) pH-Meter
pH(Sprudel) = 5,1
pH = - lg c(H₃O⁺)
c(H₃O⁺) = 10-pH
= 10-5,1
= 7,9 • 10-6 = 0,0000079 mol/L
- Details
- Geschrieben von: Wolfram Hölzel
3.3 Neutralisation
a) Versuch: Zu 10 ml 0,1 M Salzsäure (mit Universalindikator angefärbt) werden 10 ml 0,1 M Natronlauge zugegeben.
b) Beobachtung: Die Indikatorfarbe schlägt von rot nach grün um. Die Lösung erwärmt sich.
c) Erklärung: Es findet eine Protolyse-Reaktion statt; es handelt sich um eine exotherme Reaktion.
d) Reaktionsschema:
H₃O⁺ (aq) + Cl⁻(aq) + Na¹⁺ (aq) + OH⁻ (aq) → Na¹⁺(aq) + Cl⁻(aq) + 2 H₂O (l) ΔH<0
verdünnte Salzsäure + verdünnte Natronlauge → Kochsalzlösung
eigentliche Reaktion
H₃O⁺ (aq) + OH⁻ (aq) → 2 H₂O ΔRHm° = -56 kJ/mol
Bei der Reaktion zwischen verdünnte Salzsäure und verdünnte Natronlauge entsteht eine Kochsalzlösung („Nudelwasser der Chemiker“).
Der Verlauf der Neutralisation lässt sich durch Leitfähigkeitsmessung verfolgen.
Die eigentliche Reaktion bei dieser Neutralisation besteht in der Protonenübertragung von Oxonium-Ionen auf Hydroxid-Ionen, wobei aus beiden Ionenarten Wassermoleküle entstehen. Die in den Lösungen vorhandenen Begleitionen bleiben meist unverändert in der Lösung.
Achtung: Die oben angegebene Neutralisationsenthalpie findet man auch bei der Neutralisation anderer Säuren und Basen; bei der Neutralisation reagieren immer die Oxonium-Ion mit den Hydroxid-Ionen.
- Details
- Geschrieben von: Wolfram Hölzel
