2.Alkene
2.1 Ethen
2.1.1 Eigenschaften
2.1.2 Ermittlung der Summenformel
2.1.3 Strukturformel
2.1.4 Vorkommen, Gewinnung und Verwendung
2.1.5 Nachweis von Alkenen (Mehrfachbindungen)
2.1.6 Isomerien von Alkenen
2.1.7 cis-trans-Isomerie
2.2 Nomenklatur der Alkene
2.3 Katalytische Hydrierung ⇔ Eliminierung
2.4 Vergleich: Ethen – Ethan
- Details
- Geschrieben von: Wolfram Hölzel
2 Alkene
2.1 Ethen
2.1.1 Eigenschaften
- farbloses, brennbares Gas;
- die Flamme leuchtet stärker als bei Methan und Ethan;
- Siedetemperatur: -104°C
- Schmelztemperatur: - 169°C
2.1.2 Ermittlung der Summenformel
a) Qualitative Analyse (Verbrennungsanalyse)
Bei der vollständigen Verbrennung von Ethen entstehen H2O und CO2.
b) Quantitative Analyse (Bestimmung der molaren Masse)
Die molare Masse von Ethen: M(Ethen) = 28 g/mol
Die Molekülmasse von Ethen: 28 u
c) Summenformel (Molekülformel): C2H4
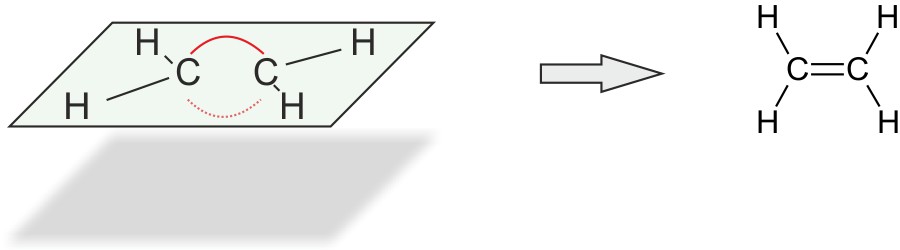
2.1.3 Strukturformel
Die Doppelbindung zwischen den beiden C-Atomen wird durch zwei Elektronenpaare gebildet. Diese stoßen sich ab. Man spricht von einer „Bogenbindung“ („Bananenbindung“).
Im Ethen Molekül betragen die Bindungswinkel 120°.
Alle Atome liegen in einer Ebene.
Die C=C-Doppelbindung verhindert die freie Drehbarkeit um die C-C-Achse.
Aufgabe: Wie viel Liter Luft benötigt man bei der Verbrennung von 2 l Ethen
{slider title="Lösung" open="false" class="icon"}
C2H4 + 3 O2 → 2 CO2 + 2 H2O
1 Molekül 3 Moleküle 2 Moleküle 2 Moleküle
Stoffmenge n: 1mol 3 mol 2 mol 2 mol
Mol. Volumen V 22,4 L 67,2 L 44,8 L
Dreisatz: x/2L = 67,7L/22,4L
Zur Vollständigen Verbrennung von 2 L Ethen benötigt man 6 L Sauerstoff, d.h. 30 L Luft.
{/sliders}
.
2.1.4 Vorkommen, Gewinnung und Verwendung
a) Vorkommen
Bei Pflanzen als Hormon (Phytohormon). Steuert:
- Fruchtreifung
- Keimwachstum
- Entwicklung
- Dickenwachstum
- Blattfall
- Informationsweitergabe an benachbarte Pflanzen
b) Gewinnung
- Cracken von Erdöl
c) Verwendung
- Reifung von Früchten
- Herstellung von organischen Stoffen (Kunststoffe, Tenside, ...)
- Details
- Geschrieben von: Wolfram Hölzel
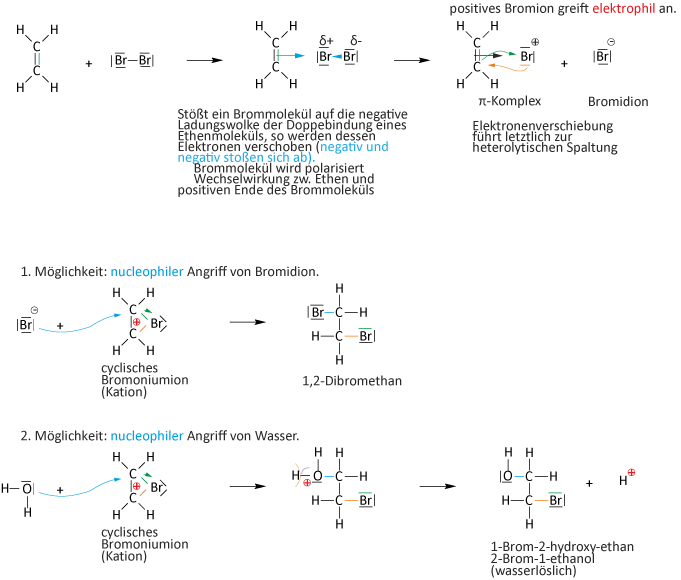
2.1.5 Nachweis von Alkenen (Doppelbindung)
Versuch: Ein Erlenmeyerkolben wird unter Wasser mit 250 ml Ethen gefüllt, anschließend werden 0,5 ml Brom dazugegeben und mit dem Stopfen verschlossen.
Alternativ: Hexen + Bromwasser (VORSICHT FALLS MAN BROM NIMMT ⇨ heftige Reaktion)
Beobachtung:
Die Bromfarbe verschwindet; Volumenabnahme; der Erlenmeyerkolben wird warm; es entsteht ein flüssiges Produkt, die Dichte ist größer als 1 g/cm³.
Auswertung:
Zwei Hypothesen:
I) Substitution:
II) Addition:
Ergebnis
Bei der Reaktion Ethen + Brom entsteht (fast) nur ein Reaktionsprodukt. „Bromwasserstoffnebel“ waren kaum zu sehen. Es fand somit eine Addition statt.
Additionsreaktionen: Reaktionen bei denen sich zwei Moleküle zu einem Molekül vereinigen! Es kommt dabei zur Anlagerung von Atomen oder Atomgruppen an Doppelbindungen (Mehrfachbindun-gen).
Reaktionsmechanismus: AE-Reaktionen (elektrophile Addition)
= typische Reaktion von Alkenen
- Details
- Geschrieben von: Wolfram Hölzel
2.1.6 Isomerien bei Ethenderivaten
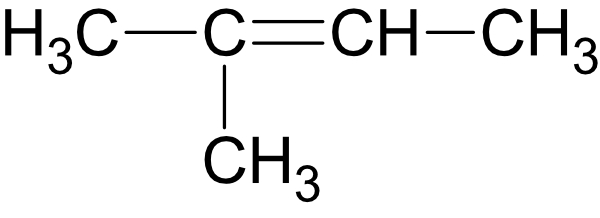
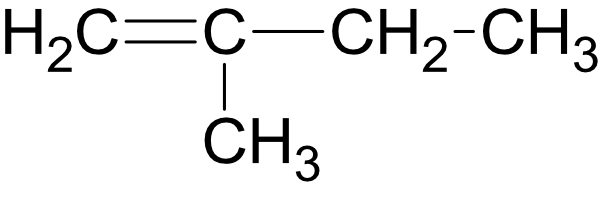
Von Dichlorethen gibt es drei isomere Verbindungen:
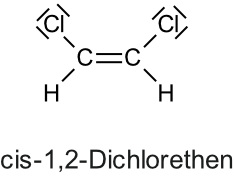
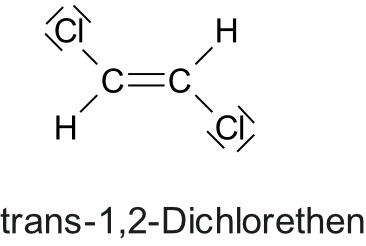
2.1.7 cis-trans-Isomerie (bzw. E/Z-Isomerie
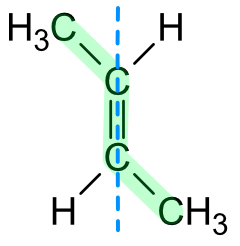
Die Doppelbindung blockiert die Drehbarkeit um die C-C-Bindungsachse. Die cis-trans-isomeren Verbindungen unterscheiden sich in ihrem physikalischen (und chemischen) Verhalten.
 |
 |
|
Dipol
|
kein Dipol (symmetrisch)
|
a) trans (lat) = hinüberschreiten, jenseits heute als (E)-Isomerie
Die wichtigen Substituenten (Alkylgruppen, Halogen-Atome, Hydroxylgruppe, ...) liegen auf der gegenüberliegenden Seite der Doppelbindung.
Heutzutage bezeichnet man es auch als (E)-Isomere, wobei (E) für entgegen gemerkt werden kann.
Beispiel: trans-But-2-en (= trans-2-Buten) = (E)-But-2-en.
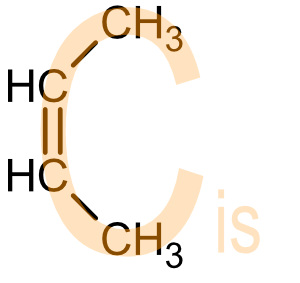
c) cis (lat) = diesseits heute auch als (Z)-Isomere
Die wichtigen Substituenten liegen auf der gleichen Seite der Doppelbindung.
Heute auch als (Z)-Isomere von zusammen.
Beispiel: cis-But-2-en (=cis-2-Buten) = (Z)-But-2-en
Eselbrücke: cis: Ein cis-Molekül hat die Form wie ein "C" von "cis".
- Details
- Geschrieben von: Wolfram Hölzel
2.2 Nomenklatur der Alkene
Da die Nomenklatur der Alkene ähnlich zur Nomenklatur der Alkane ist, soll dieses Thema gleich als Übung besprochen werden. Schüler des Limes-Gymnasium Welzheims: siehe AB!
a) Nenne die homologe Reihe der Alkene bis Decen.
{slider title="Lösung - Homologe Reihe" open="false" class="icon"}
Hinweis: Methen kann es nicht geben; wie sollte bei einem C auch eine C=C-Doppelbindung entstehen. ;-)
Ethen - Propen - Buten - Penten - Hexen - Hepten - Octen - Nonen - Decen
{/sliders}
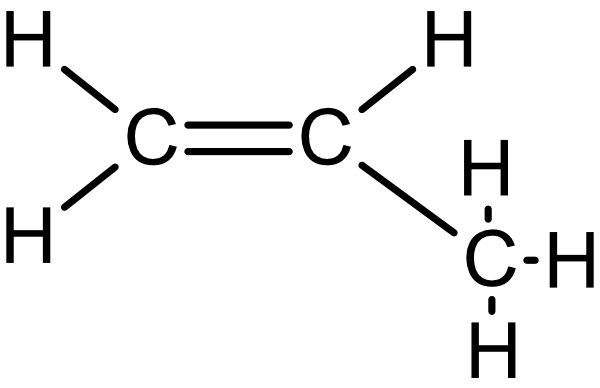
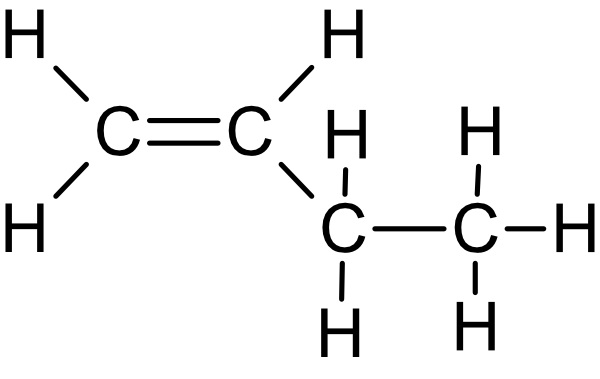
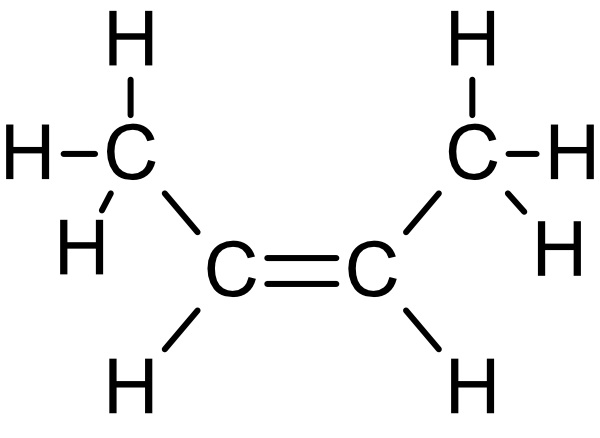
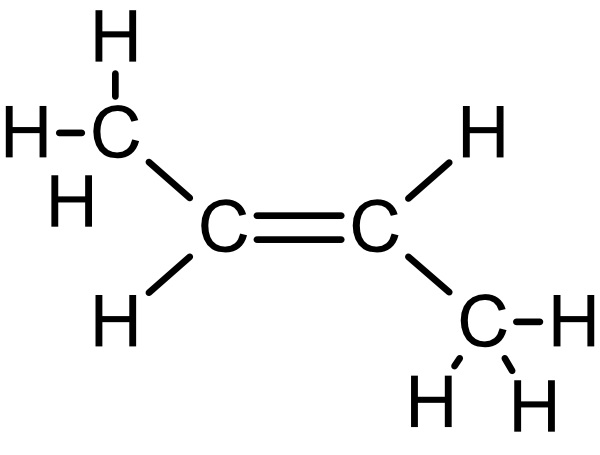
b) Zeichne die Strukturformeln von Propen, 1-Buten, cis-2-Buten, trans-2-Buten und 1,3-Butadien.
{slider title="Lösung" open="false" class="icon"}
Propen:
1-Buten:
cis-2-Buten:
trans-2-Buten:
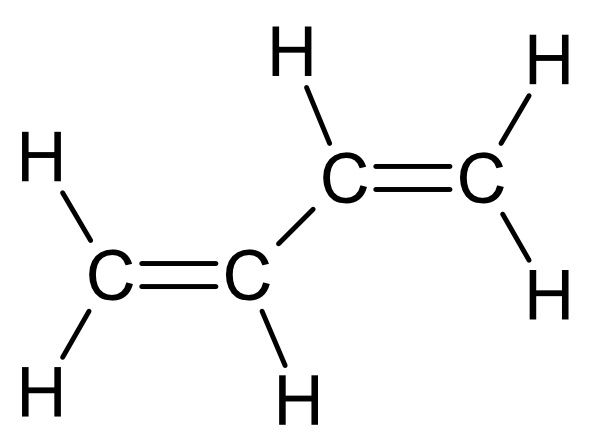
1,3 Butadien:
{/sliders}
c) Gib die Molekülformel von Propen an.
{slider title="Lösung - Molekülformel von Propen" open="false" class="icon"}
C₃H₆
{/sliders}
d) Benenne die folgende Verbindungen.
I:
II:
{slider title="Lösung" open="false" class="icon"}
I.: Penta-1,3-dien
II. cis-Pent-2-en
{/sliders}
e) Zeichne die Strukturformeln der isomeren Pentene und benenne die Verbindungen.
{slider title="Lösung - Pentene" open="false" class="icon"}
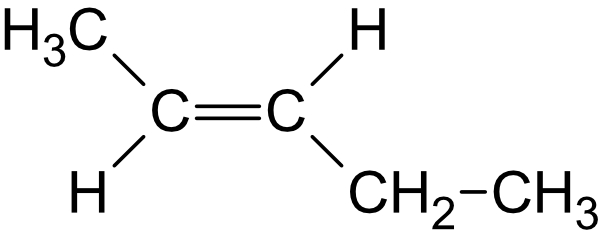
Pent-1-en:
cis-Pent-2-en:
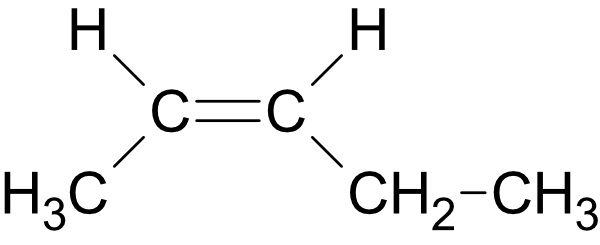
trans-Pent-2-en:
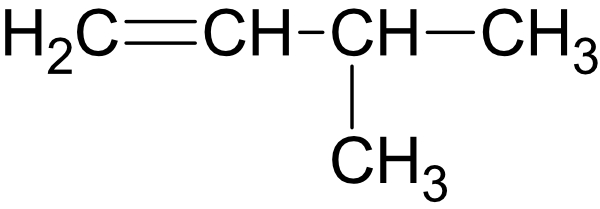
3-Methylbut-1-en:
2-Methylbut-2-en:
2.Methylbut-1-en:
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel