3 Protolyse-Reaktionen
3.1 Chlorwasserstoff-Gas und Wasser (Springbrunnen)
Chlorwasserstoff: Summenformel HCl, polare Atombindung, Gas, stechender Geruch 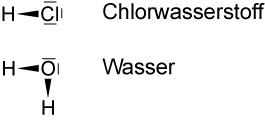
Wasser: Summenformel H₂O, polare Atombindung, Flüssigkeit, geruchslos
a) Versuch:
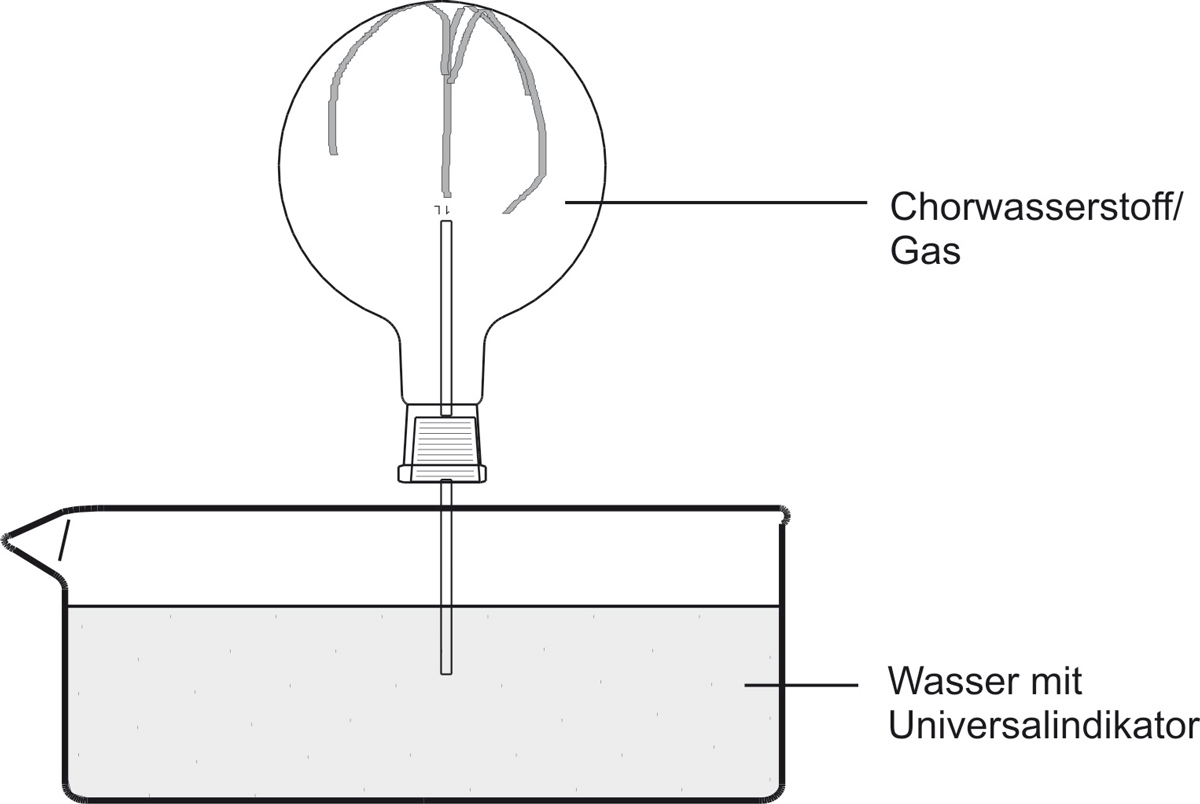
b) Beobachtung:
Das Wasser „schießt“ bergauf in den Rundkolben. Die Indikatorfarbe schlägt nach rot/gelb um. Die rote wässrige Lösung ist geruchlos.
c) Reaktionsgleichung – Struktur/Lewisformel:
Es gibt zwei mögliche Reaktionsgleichungen (wenn man zunächst die Säurestärke vernachlässigt). Welche zwei Reaktionsgleichungen sind das?
{slider title="Lösung" open="false" class="icon"}
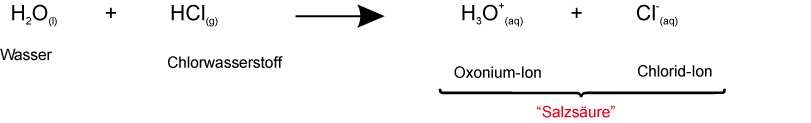
1. Möglichkeit:
2. Möglichkeit:
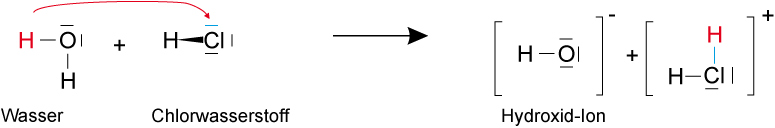
Chlorwasserstoff ist die stärkere Säure, Hydroxid-Ionen ist eine sehr starke Base (vgl später). Durch Elektrolyse wird die erste Möglichkeit bestätigt.
{/sliders}
Nachweis der gebildeten Ionen:
- Leitfähigkeitsmessung
- durch Elektrolyse: An der Anode (+-Pol) entsteht dabei Cl₂-Gas. Somit müssen in der verdünnten Salzsäure Chlorid-Ionen (Cl⁻-Ionen) vorliegen.

- durch Indikator: Die Gelbfärbung bei Bromthymolblau zeigt Oxonium-Ionen (H₃O⁺) an.
Komplette Lösung:
{slider title="Lösung" open="false" class="icon"}
Reaktionsgleichung
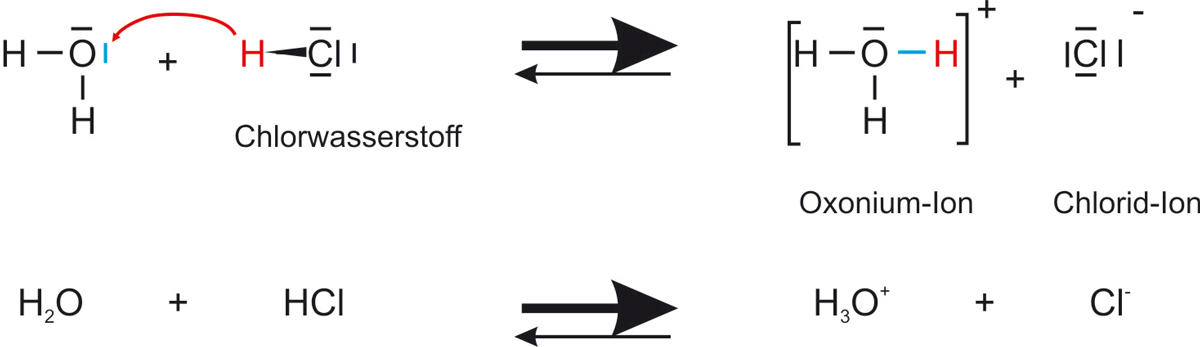

Verdünnte Salzsäure enthält hydratisierte Oxonium- und Chlorid-Ionen und Wassermoleküle.
d) Protolyseschema
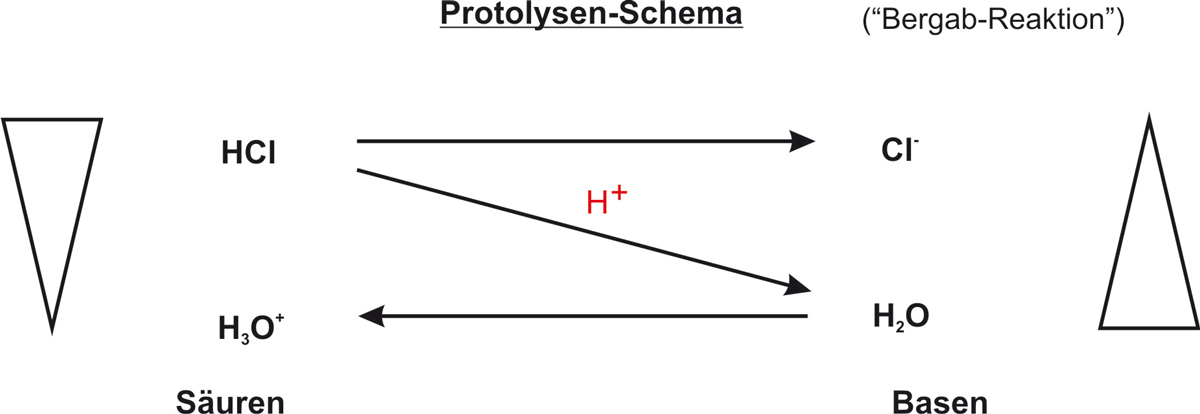
{/sliders}
e) Erklärung:
Chlorwasserstoff-Gas reagiert mit Wasser. Im Zylinder entsteht ein Unterdruck. Die Oxonium-Ionen färben den Universalindikator/Bromthymolblau rot/gelb.
Salzsäure = wässrige Lösung des Gases Chlorwasserstoff
Wenn man sehr viel HCl-Gas in Wasser einleitet, reagieren nicht mehr alle HCl-Moleküle mit den H₂O-Molekülen. Diese HCl-Moleküle liegen „gelöst“ vor. Es ist so „rauchende“ bzw. konzentrierte Salzsäure entstanden.
| Leitfähigkeit | Geruch | Indikatorpapier | Teilchen | |
| verdünnte Salzsäure | + | - | rot | H₂O, H₃O⁺, Cl⁻ |
| rauchende Salzsäure | + | + | rot | H₂O, H₃O⁺, Cl⁻, HCl |
