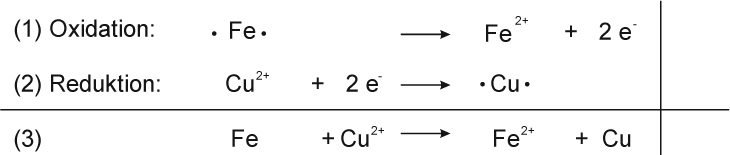Elektrochemie
1 Freiwillig ablaufende Redoxreaktionen
1.1 Wiederholung bekannter Begriffe und Definitionen
Versuch 1: Magnesium + Sauerstoff
Magnesium verbrennt mit stark leuchtender Flamme. Ein weißer Feststoff bleibt übrig.
Formuliere die Reaktionsgleichungen und ein Redoxschema:
{slider title="Lösung" open="false" class="icon"}
Zunächst vereinfacht atomar (Natürlich liegt Sauerstoff molekular vor):
Vollständiger:
Reaktionsgleichung: 2 Mg + O2 → 2 MgO ΔH < 0
Redoxschema:
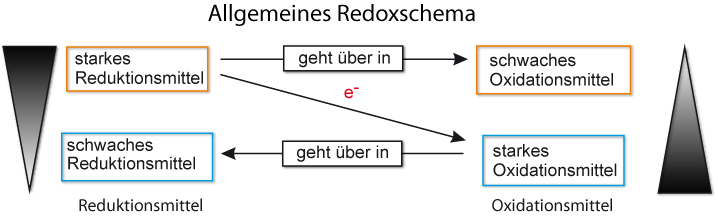
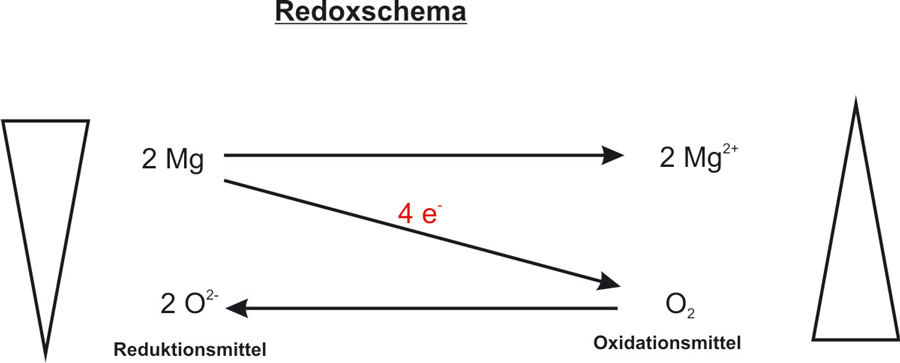
{/sliders}
Einfach ist es, wenn man die Teilreaktionen (Oxidation und Reduktion) erstellt und dann erst die Redoxreaktion. Versucht mal diese zu formulieren:
{slider title="Lösung" open="false" class="icon"}
Oxidation: Mg → Mg²+ + 2 e- | • 2
Reduktion: O2 + 4 e- → 2 O2- | • 1
-----------------------------------------------------
Redoxreaktion: 2 Mg + O2 → 2 Mg2+ + 2 O2-
{/sliders}
Begriffe und Definitionen
Oxidation = Elektronenabgabe; Erhöhung der Oxidationszahlen
Reduktion = Elektronenaufnahme; Erniedrigung der Oxidationszahlen
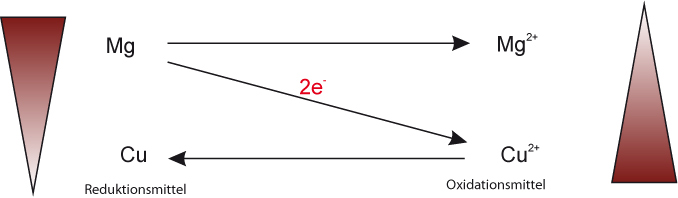
Oxidationsmittel: Elektronenakzeptor, („Elektronenräuber“); wird bei der Reaktion selbst reduziert. [Eselsbrücke: Putzmittel]
Reduktionsmittel: Elektronendonator („ Elektronenspender“) [ nicht freiwillig ]; wird bei der Reaktion selbst oxidiert.
Redoxreaktionen: Reaktionen mit Elektronenübertragung.
Oxidation und Reduktion laufen gleichzeitig ab.
Ein Reduktionsmittel gibt Elektronen ab, die es später wieder aufnehmen kann. Es wird also zu einem Oxidationsmittel.
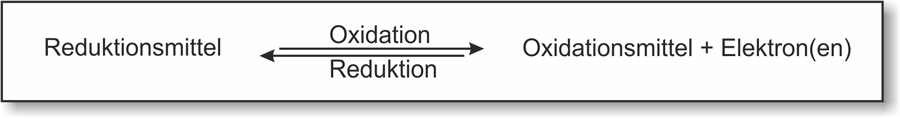
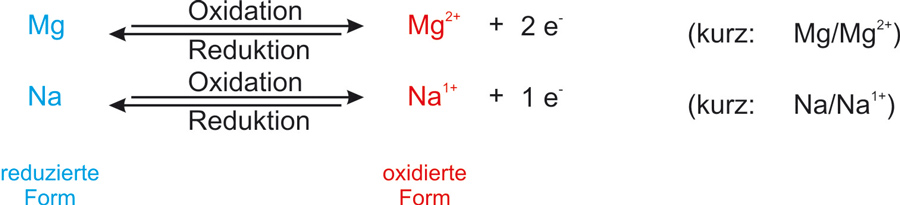
Reduktionsmittel und Oxidationsmittel bilden ein korrespondierendes Redoxpaar:
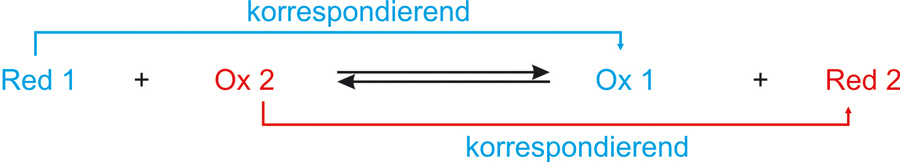
Die übliche Kurzschreibweise für ein Redoxpaar:
Reduzierte Form/oxidierte Form
Me/Men+
Bei jeder Redoxreaktion sind zwei korrespondierende Redoxpaare beteiligt (analog: Protolysereaktion)
Achtung:
Die Zahl der abgegebenen und aufgenommenen Elektronen muss gleich sein; die Elektronenbilanz muss stimmen (gemeinsames Vielfaches!).
- Details
- Geschrieben von: Wolfram Hölzel
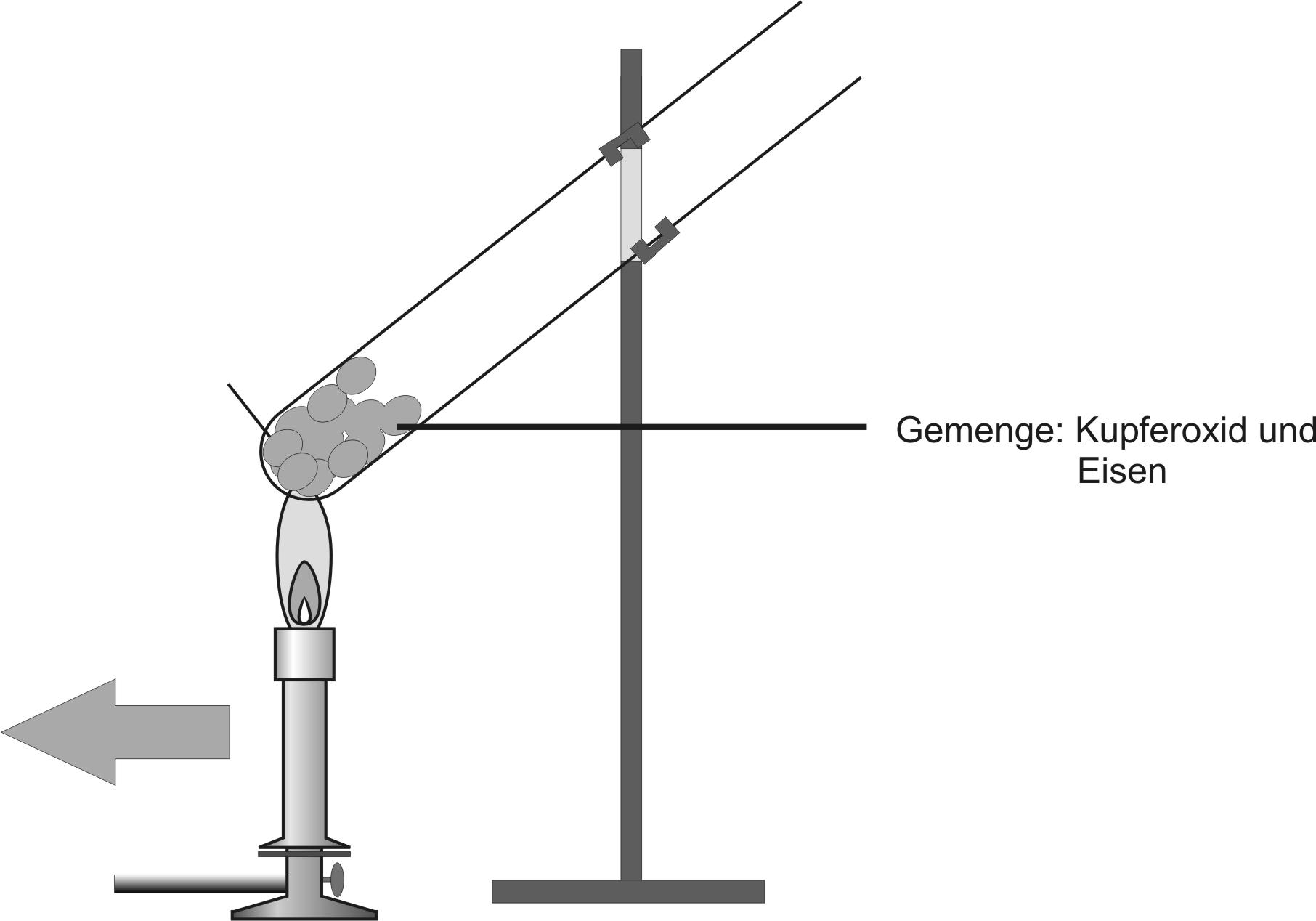
2. Versuch: Kupfer(II)-oxid + Eisen
Kupferoxid ist ein Salz (Ionenverbindung) und besteht aus Cu²⁺-Ionen und O²⁻-Ionen (Oxid-Ionen). Es reagiert bei dieser Reaktion exotherm. Als Produkte erhält man einen rotbräunlichen und einen grauen, porösen Feststoff.
Formuliere dafür die Teilreaktionen und die Redoxreaktion, sowie die Teilchengleichung und ein Redoxschema. Zum Abschluss die Reaktionsgleichung als Stoffgleichung (Summen/Verhältnisformel).
{slider title="Lösung: Eisen und Kupfer(II)-Oxid" open="false" class="icon"}
Teilreaktionen:
Teilchengleichung: Fe + Cu²⁺ O²⁻ → Fe²⁺ O²⁻ + Cu
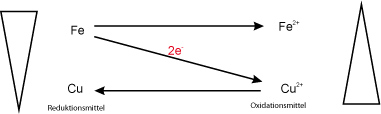
Redoxschema:
Reaktionsgleichung:
Fe + CuO → FeO + Cu ΔH < 0
Eisen Kupfer(II)-oxid Eisen(II)-oxid Kupfer
Metall, grau Salz, schwarz Salz, Metall,rot-braun
{/sliders}
3. Versuch: Kupferoxid + Zink
Dieser Versuch ist ähnlich zu dem Kupferoxid und Eisen; nur reagiert dieser viel heftiger. Auch hier entsteht ein rötlicher Feststoff. Formuliere hierfür die Teilchgleichung die die Reaktionsgleichung in Verhältnisformeln.
{slider title="Lösung" open="false" class="icon"}
Teilchengleichung: Zn + Cu²⁺ O²⁻ → Zn²⁺ O²⁻ + Cu ΔH < 0
Reaktionsgleichung mit Verhältnisformeln: Zn + CuO → ZnO + Cu ΔH < 0
{/sliders}
4. Versuch: Kupferoxid + Mg
Beim letzten Versuch dieser Reihe lässt man in einer Magnesia-Rinne Kupfer(II)-Oxid und Magnesium reagieren. Diese Reaktion ist noch heftiger (deshalb auch nur die Magnesia-Rinne und nicht in einem Reagenzglas).
Formuliere hierfür:
- Teilgleichungen
- Redox-Reaktionsgleichung aus den Teilgleichung
- Teilchengleichung
- Redoxschema
- Stoffgleichung
{slider title="Lösung" open="false" class="icon"}
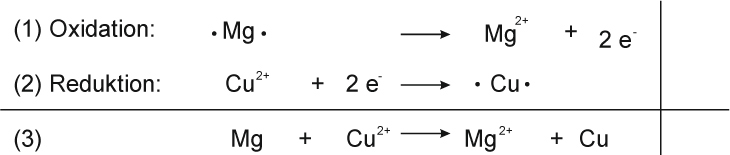
Teilgleichungen:
Teilchengleichung:
Mg + Cu²⁺ O²⁻ → Mg²⁺ O²⁻ + Cu
Redoxschema:
Reaktionsgleichung mit Verhältnisformel:
Mg + CuO → MgO + Cu ΔH < 0
Magnesium Kupfer(II)-oxid Magnesium(II)-oxid Kupfer
Metall, grau Salz, schwarz Salz, weiß Metall, rot-braun
{/sliders}
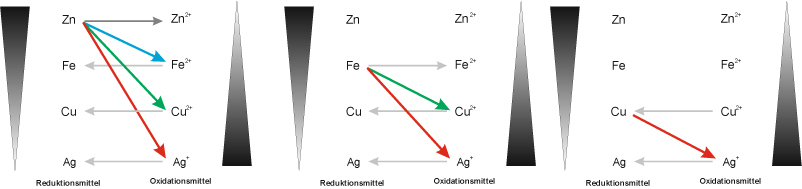
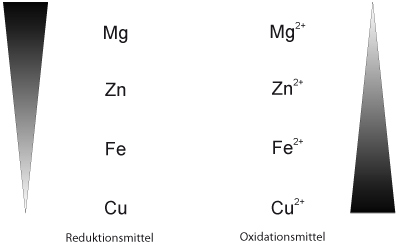
Reduktions- und Oxidationsfähigkeit im Vergleich:
Die Reaktionen verliefen jetzt unterschiedlich heftig. Überlegt Euch, wie man diese "Heftigkeit" innerhalb eines oder mehreren Redoxschemata darstellen kann.
Mögliche Lösung beinhaltet jetzt nicht Magnesium (sorry), dafür Silber.
{slider title="Lösung" open="false" class="icon"}
Zum Üben hier ohne Silber, dafür mit :
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
1.2 Erstellung einer Redoxreihe
Allgemein: Metallatome können als Reduktionsmittel, Metallkationen als Oxidationsmittel reagieren. Durch Kombination eines beliebigen Metalls mit den Kationen eines anderen Metalls (bzw. dessen Salz) kann daher die relative Stärke eines Oxidations- bzw. Reduktionsmittels bestimmt werden.
Problem: Welches Metall (Zink, Kupfer, Silber, Eisen) sind stärkere Reduktionsmittel.
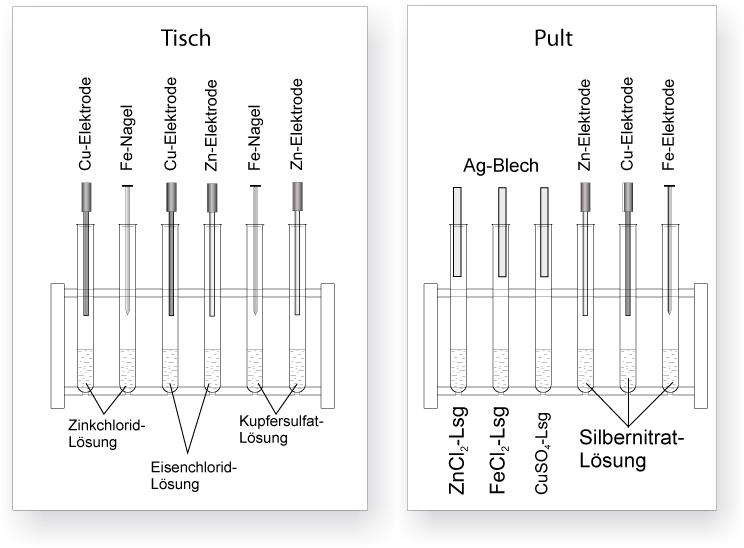
Experiment: vgl. AB Redoxreaktionen – Elektronenübergangreaktionen
Beobachtung:
| Zn²⁺ | Cu²⁺ | Fe²⁺ | Ag¹⁺ | |
| Zn | x |
rotbrauner Feststoff |
Eisenniederschlag | Silberüberzug |
| Cu | nichts | x | nichts | Silberüberzug |
| Fe | nichts | rotbrauner Feststoff | x | Silberüberzug |
| Ag | nichts | nichts | nichts | x |
Auswertung:
Welche Teilchen liegen vor der Reaktion vor?
Cu + Zn²⁺ ⇨ keine Reaktion
Fe + Zn²⁺ ⇨ keine Reaktion
Cu + Fe²⁺ ⇨ keine Reaktion
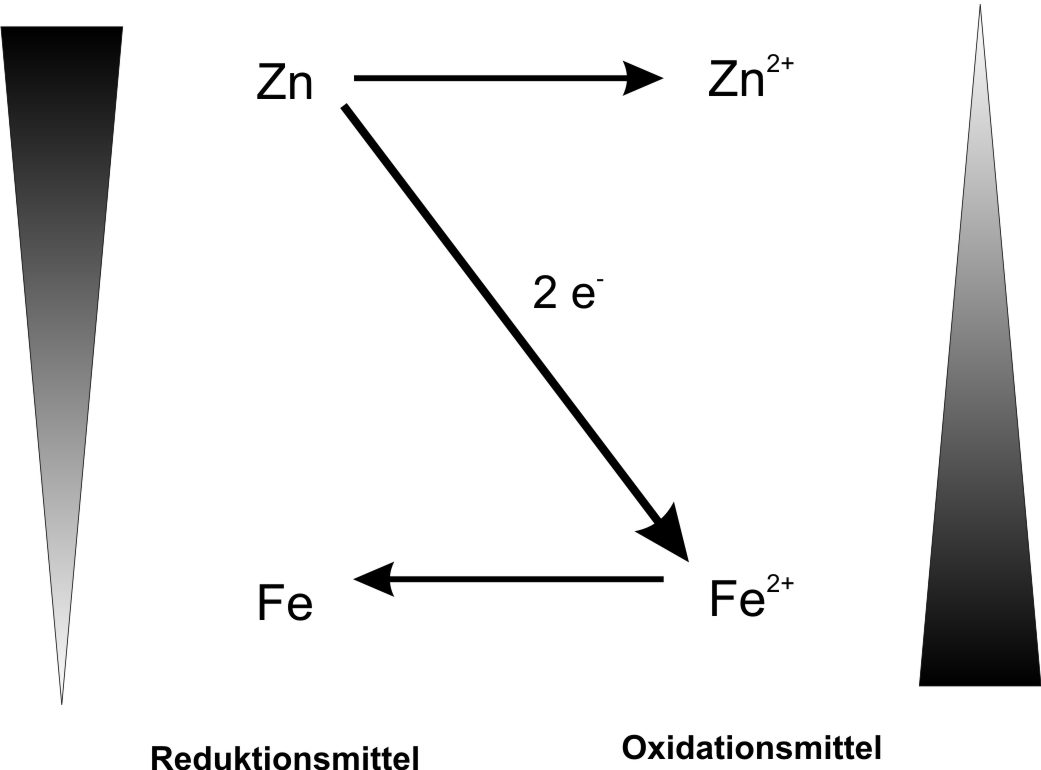
Zn + Fe²⁺ ⇨ Eisenniederschlag
Zn + Cu²⁺ ⇨ rotbrauner Niederschlag
Fe + Cu²⁺ ⇨ rotbrauner Niederschlag
Ag + Zn²⁺ ⇨ keine Reaktion
Ag + Cu²⁺ ⇨ keine Reaktion
Ag + Fe²⁺ ⇨ keine Reaktion
Ag¹⁺ + Zn ⇨ Silberüberzug
Ag¹⁺ + Cu ⇨ Silberüberzug
Ag¹⁺ + Fe ⇨ Silberüberzug
Wie liegen die Teilchen in wässriger Lösung vor?
Als Ionen mit einer Hydrathülle; Schreibweise z.B. Zn²⁺ (aq)
Wie lassen sich die Beobachtungen erklären? Formuliert für stattfindende Reaktionen die
- Teilreaktionen,
- Teilchenreaktion,
- Reaktionsgleichung und
- unter Umständen dazugehörige Redoxschemata.
Reagenzglas 4: Zn-Elektrode in Eisen(II)-chloridlösung
{slider title="Lösung" open="false" class="icon"}
Oxidation: Zn → Zn²⁺ (aq) + 2 e⁻
Reduktion: Fe²⁺ (aq) + 2 e⁻ → Fe
----------------------------------------------------------------------------
Eigentliche Reaktion: Zn + Fe²⁺(aq) → Zn²⁺(aq) + Fe
Teilchengleichung: Zn + Fe²⁺(aq) + 2 Cl⁻ (aq) → Zn²⁺(aq) + 2 Cl⁻(aq) + Fe
Reaktionsgleichung: Zn + FeCl₂ → ZnCl₂ + Fe
Redoxschema:
{/sliders}
Reagenzglas 5: Eisennagel in Kupfer(II)-sulfatlösung
{slider title="Lösung" open="false" class="icon"}
Oxidation: Fe → Fe²⁺(aq) + 2 e⁻
Reduktion: Cu²⁺(aq) + 2 e⁻ → Cu
-----------------------------------------------------------------------
Eigentliche Reaktion: Fe + Cu²⁺(aq) → Fe²⁺(aq) + Cu
Teilchengleichung: Fe + Cu²(aq) + SO₄²⁻(aq) → Fe²⁺(aq) + SO₄²⁻ (aq) + Cu
Reaktionsgleichung: Fe + CuSO₄ → FeSO₄ + Cu
{/sliders}
Reagenzglas 6: Zinkelektrode in Kupfer(II)-sulfatlösung
{slider title="Lösung" open="false" class="icon"}
Oxidation: Zn → Zn²⁺(aq) + 2 e⁻
Reduktion: Cu²⁺(aq) + 2 e⁻ → Cu
--------------------------------------------------------------------
Eigentliche Reaktion: Zn + Cu²⁺(aq) → Zn²⁺(aq) + Cu
Teilchengleichung: Zn + Cu²⁺(aq) + SO₄²⁻(aq) → Zn²⁺(aq) + SO₄²⁻(aq) + Cu
Reaktionsgleichung: Zn + CuSO₄ → ZnSO₄ + Cu
{/sliders}
Reagenzglas 10,11,12: Zink/Eisen/Kupferelektrode in Silber(I)-nitratlösung
{slider title="Lösung" open="false" class="icon"}
RG 10: Oxidation: Zn → Zn²⁺(aq) + 2 e⁻
RG 11: Oxidation: Fe → Fe²⁺ (aq) + 2e⁻
RG 12: Oxidation: Cu → Cu²⁺ (aq) + 2 e⁻
RG 10-12 Reduktion: 2 Ag¹⁺(aq) + 2 e⁻ → 2 Ag
{/sliders}
Die Erklärung, warum und wie manche Reaktionen ablaufen findet man auch wieder in den Redox-Schemata; Überlegt euch, wie diese für die Reaktionen aussehen.
{slider title="Lösung" open="false" class="icon"}
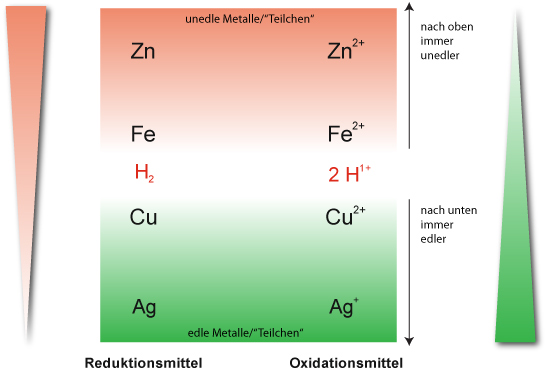
Redoxreihe: Das Zinkatom gibt am leichtesten Elektronen ab, das Silber am schwersten. Ordnet man Atome entsprechend ihrem Reduktionsvermögen, erhält man eine Reihe, in der oben (links) unedle und unten (rechts) Edelmetalle stehen.
Das Oxidationsvermögen nimmt von oben nach unten zu.
{/sliders}
Zusammenfassung: Redoxreaktionen laufen bevorzugt (freiwillig) so ab, dass das stärkere Reduktionsmittel mit dem stärkeren Oxidationsmittel zum schwächeren Reduktionsmitten und zum schwächeren Oxidationsmittel reagiert.
- Details
- Geschrieben von: Wolfram Hölzel
Wiederholung: Oxidationszahl und Redoxreaktionen mit Molekülen
Oxidationszahl
Def.: Die Oxidationszahl gibt an, welche Ladung ein Atom in einem Molekül oder in einem anderen Teilchen hätte, wenn alle am Aufbau des Teilchens beteiligten Atome in Form von Ionen vorlägen.
Die sich für die Atome in der Verbindung ergebenden formalen Ladungszahlen nennt man Oxidationszahlen. Zur Unterscheidung von Ionenladungen werden sie als römische Zahlen an die Elementsymbole geschrieben.
Ermittlung der Oxidationszahl
- Schritt: Strukturformel erstellen.
- Schritt: Ermittlung der Elektronegativität aller Elemente.
- Schritt: Bindungselektronen werden formal dem elektronegativeren Bindungspartner zugeteilt. Besitzen die Bindungspartner die gleiche Elektronegativität erhalten sie je die Hälfte der Bindungselektronen.
- Schritt: Vergleicht man die Elektronenzahl eines Atoms, die man aus Schritt 3 erhält mit der Elektronenzahl im elementaren Zustand (= Hauptgruppennummer im PSE), so erhält man die Oxidationszahl.
Bsp.: Wasser
Oxidationszahl = Hauptgruppennummer – Elektronenzahl unter Berücksichtigung der EN
Oxidationszahl(O) = 6 - 8 = - 2 = - II
Oxidationszahl(H) = 1 - 0 = +1 = +I
5. Schritt: Kontrolle: Summe der Oxidationszahlen:
a) bei Molekülen = 0
b) bei Ionen = Ionenladungszahl
Hinweis: Die Oxidationszahl für C bei CO2 müsste natürlich +IV sein.
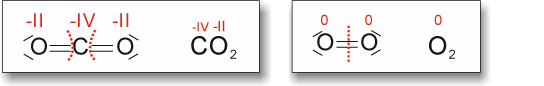
Faustregel:
Achtung, es gibt Faustregeln, die aber immer wieder zu Fehlern (häufig auch Leichtsinnsfehlern) verleiten. Deshalb rate ich von diesen Faustregeln ebenso ab wie vom Überschlagen im Kopf, sofern man eine Strukturformel erstellen und die Oxidationszahlen darüber bestimmen kann. Bei komplexeren, anorganischen Molekülen helfen dann die folgenden Faustformeln:
- Fluor immer: –I
- Wasserstoff: +I
- Sauerstoff: -II
- Halogene: -I (sofern nicht mit Sauerstoff oder einem elektronegativeren Halogen verbunden sind)
- Metalle meist positiv
Alkalimetalle +I
Erdalkalimetalle +II
Übungen:
Mit Hilfe der Oxidationszahl lassen sich die Begriffe Oxidation und Reduktion neu fassen:
Oxidation: (Elektronenabgabe) bedeutet eine Erhöhung der Oxidationszahl.
Reduktion: (Elektronenaufnahme) bedeutet eine Erniedrigung der Oxidationszahl.
Redoxreaktionen: sind Vorgänge bei denen sich die Oxidationszahlen der beteiligten Atomarten ändern.
a) Vollständige Verbrennung von Kohlenstoff
{slider title="Lösung" open="false" class="icon"}
Hinweis: Die Oxidationszahl für C bei CO2 müsste natürlich +IV sein. ![]()
Kohlenstoff Sauerstoff Kohlenstoff(IV)-dioxid
Kohlenstoff wird oxidiert, Sauerstoff wird reduziert.
{/sliders}
b) Reaktion von Wasserstoff mit Sauerstoff
{slider title="Lösung" open="false" class="icon"}
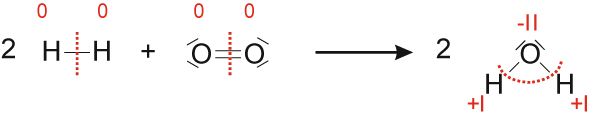
Wasserstoff Sauerstoff Wasser
{/sliders}
Aufgaben
a) Formuliere die Reaktion von Wasserstoff mit Stickstoff zu Ammoniak (NH₃)
{slider title="Lösung" open="false" class="icon"}
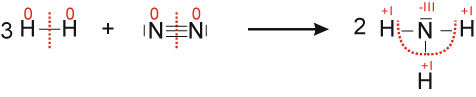
3 H₂ + N₂ → 2 NH₃ ΔH < 0
{/sliders}
b) Formuliere die Reaktion von Schwefel mit Sauerstoff zu Schwefeldioxid (SO₂) ⇨ ohne Lewis- bzw. Strukturformeln; dafür mit Faustformeln (vgl. oben):
{slider title="Lösung" open="false" class="icon"}
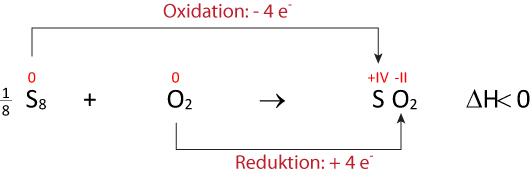
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
1.3 Stellung des Redoxpaares ( ½ H₂/H⁺ + 1 e⁻) in der Redoxreihe
Siehe Arbeitsblatt zu den Experimenten:
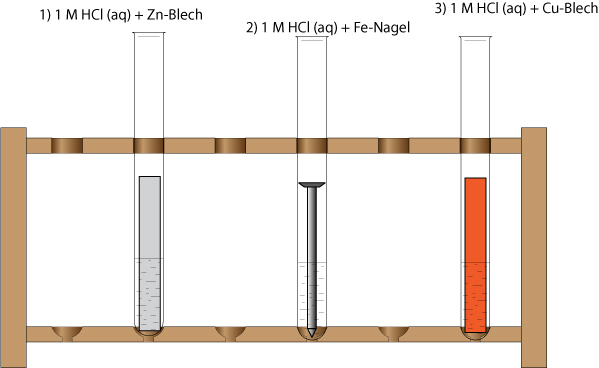
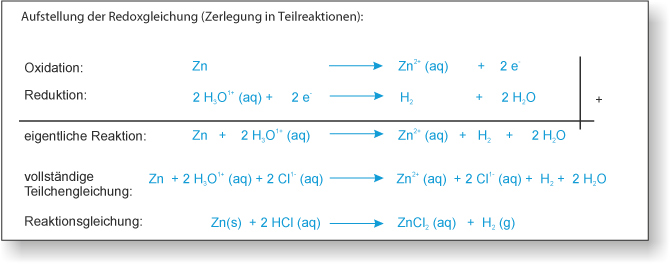
1) zu 10 ml 1 M Salzsäure (H₃O⁺(aq) und Cl⁻ (aq)) wird ein Zinkblech gegeben;
Beobachtung: Es entsteht ein Gas, das Zinkblech "verschwindet" nach einiger Zeit.
Erkläre diese Beobachtung (am besten mit Reaktionsgleichungen)
{slider title="Lösung" open="false" class="icon"}
Gas = Wasserstoff (H₂);
"Verschwinden" = Zink gibt zwei Elektronen ab, wird zu einem Ion und löst sich dann auf (Hydrathülle).
{/sliders}
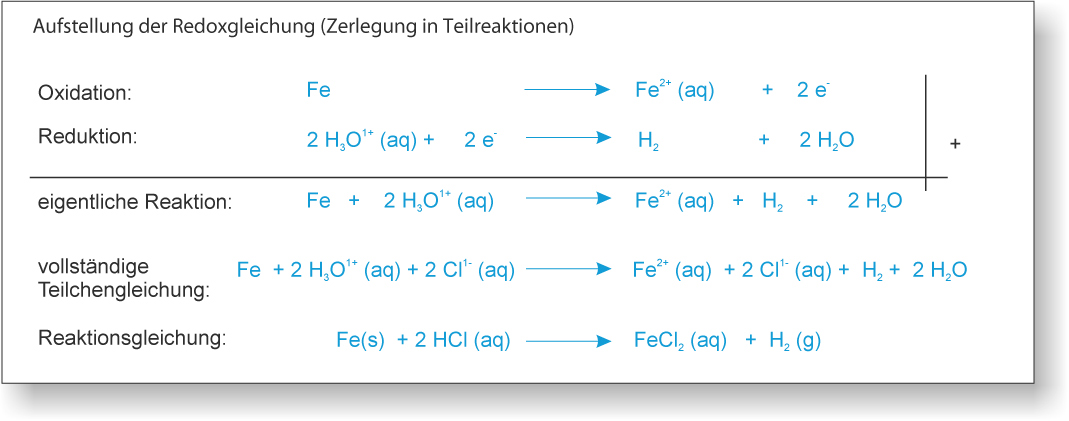
2) zu 10 ml 1 M Salzsäure (H₃O⁺(aq) und Cl⁻ (aq)) wird ein Fe-Nagel gegeben;
Es entsteht ein Gase, der Eisennagel verschwindet nach einiger Zeit."
{slider title="Lösung" open="false" class="icon"}
Gas = Wasserstoff (H₂);
"Verschwinden" = Eisen gibt zwei Elektronen ab, wird zu einem Ion und löst sich dann auf (Hydrathülle).
{/sliders}
3) zu 10 ml 1 M Salzsäure (H₃O⁺(aq) und Cl⁻ (aq)) wird ein Kupferblech gegeben
Keine Veränderung; Setze das Wasserstoff-Redoxpaar in die richtige Stelle der Redoxreihe.
{slider title="Lösung" open="false" class="icon"}
Ergebnis (Redoxreihe): Da die verdünnte Salzsäure nicht mit Kupfer reagiert, steht das Redoxpaar (1/2 H₂ / H⁺+ 1 e⁻) zwischen Eisen und Kupfer.
Merke: Die Metalle, die mit Oxonium-Ionen (Hydronium-Ionen) in einer Redoxreaktion reagieren sind „unedel“.
„Edle“ Metalle (u.a. Kupfer, Silber, Gold) stehen in der Redoxreihe unterhalb diesem Redoxpaar ( ½ H₂/H⁺ + 1 e⁻) und reagieren nicht mit den Oxonium-Ionen unter Wasserstoffbildung.
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel