Chemisches Gleichgewicht
1 Umkehrbare Reaktionen
1.1 Beispiel: Ammoniumchlorid
a) Bildung von Ammoniumchlorid (vgl. Versuchsskizze - Heftaufschrieb)
Über ein geöffnetes Schnappdeckelglas stellt man ein umgekehrtes Becherglas, in welchem sich konzentrierte Salzsäure befindet.
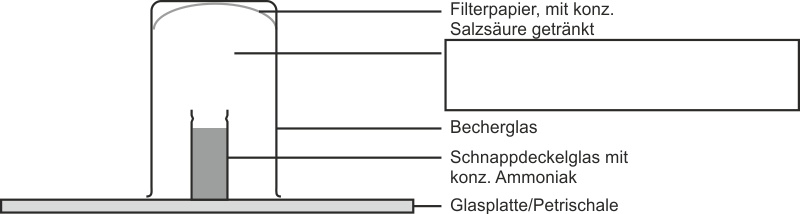
Beobachtung:
In dem Raum wischen Schnappdeckelglas und Filterpapier bildet sich ein weißer Rauch. Auf der Glasplatte bildet sich eine Schicht mit einem kristallinen weißen Feststoff.
Auswertung:

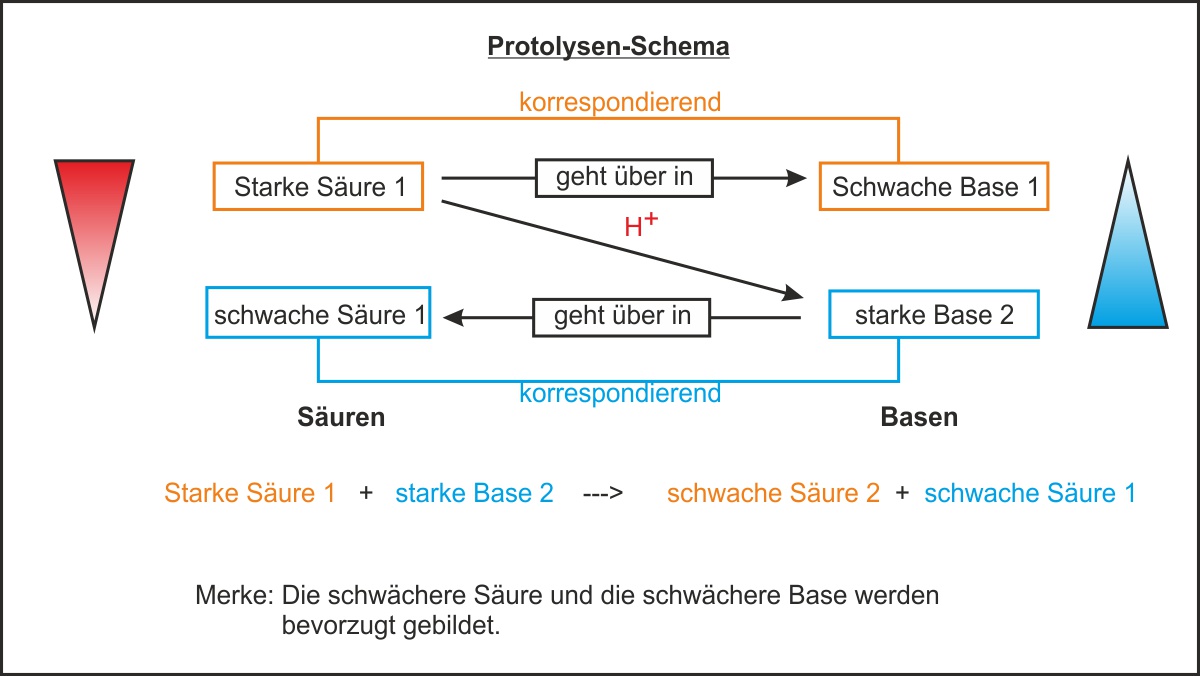
In der obigen Abbildung sind Fehler drin:
Richtig ist: Starke Säure 1 + starke Base 2 --> schwache Base 1 + schwache Säure 2
(Dank an Fiona Ulrich für die Korrektur).
b) Zerlegung von Ammoniumchlorid (vgl. Versuchsskizze: s. Schülerübungen AB )
Experiment: Man erhitzt in einem Reagenzglas festes Ammoniumchlorid.
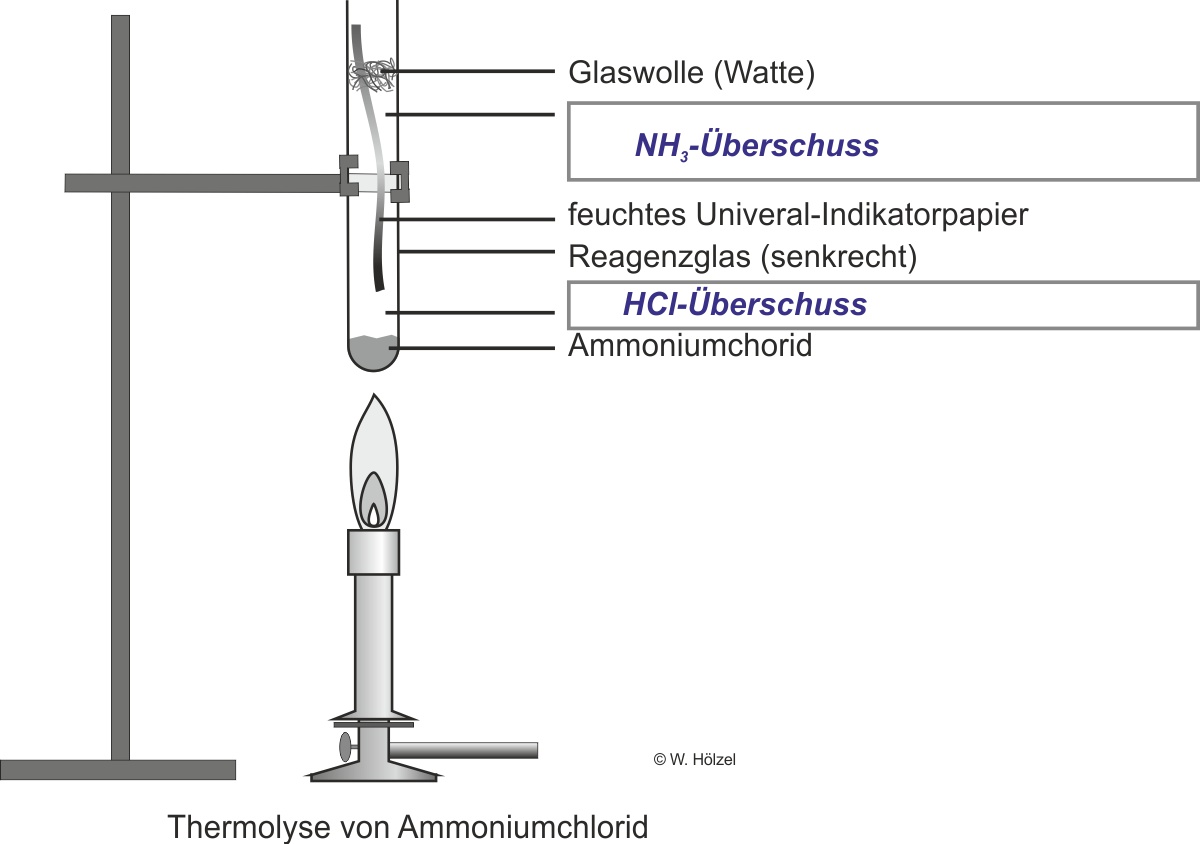
Beobachtung: das pH-Papier färbt sich sowohl rot (Hinweis einer Säure) wie auch blau (Hinweis einer Base).
Auswertung:

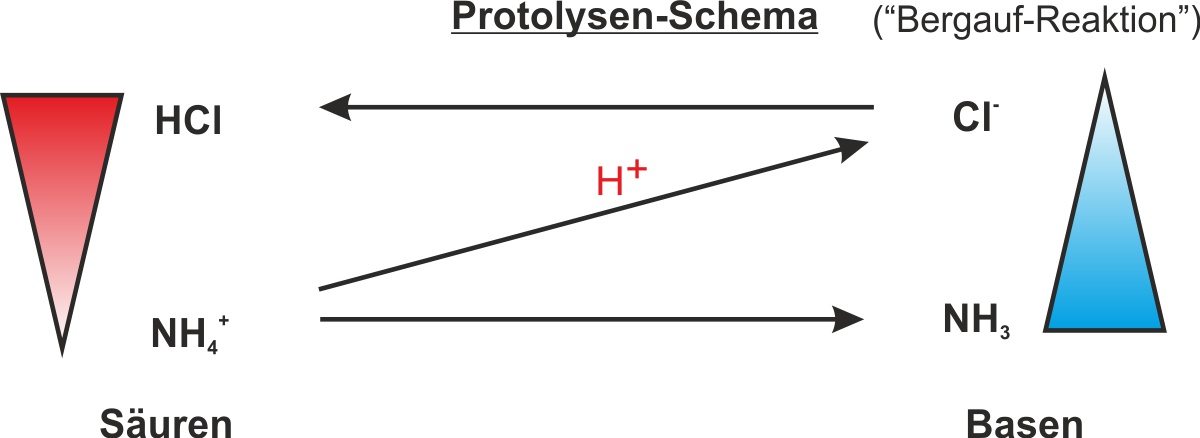
c) Bildung und Zerlegung von Ammoniumchlorid
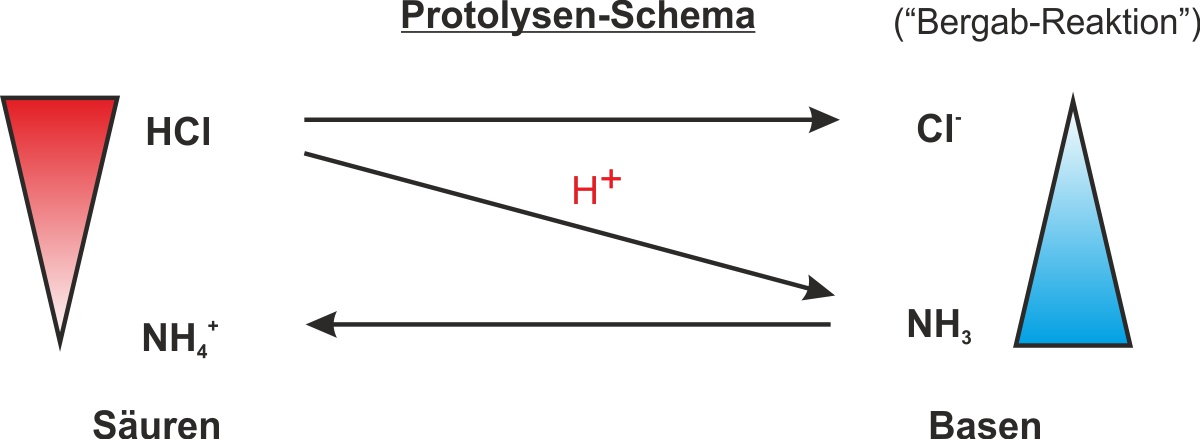
NH₃ + HCl ⇌ NH₄Cl
Ammoniak Chlorwasserstoff Ammoniumchlorid
Hinweis: Die Reaktionen auf dem befeuchteten Indikatorpapier lauten:
HCl + H₂O → H₃O⁺ + Cl⁻
NH₃ + H₂O → NH₄⁺ + OH⁻
- Details
- Geschrieben von: Wolfram Hölzel
1.2 Beispiel: Calciumhydroxid
a) Bildung von Calciumhydroxid („Löschen von gebranntem Kalk“)

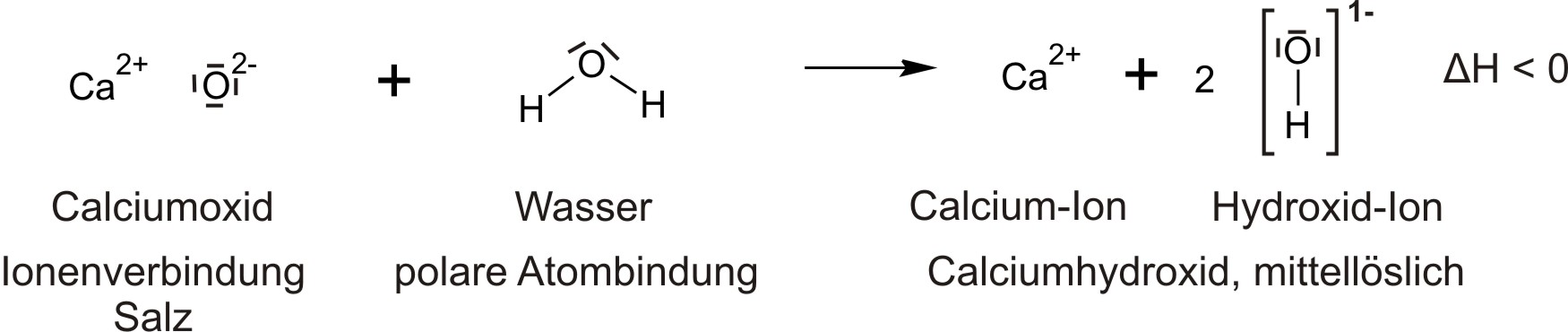
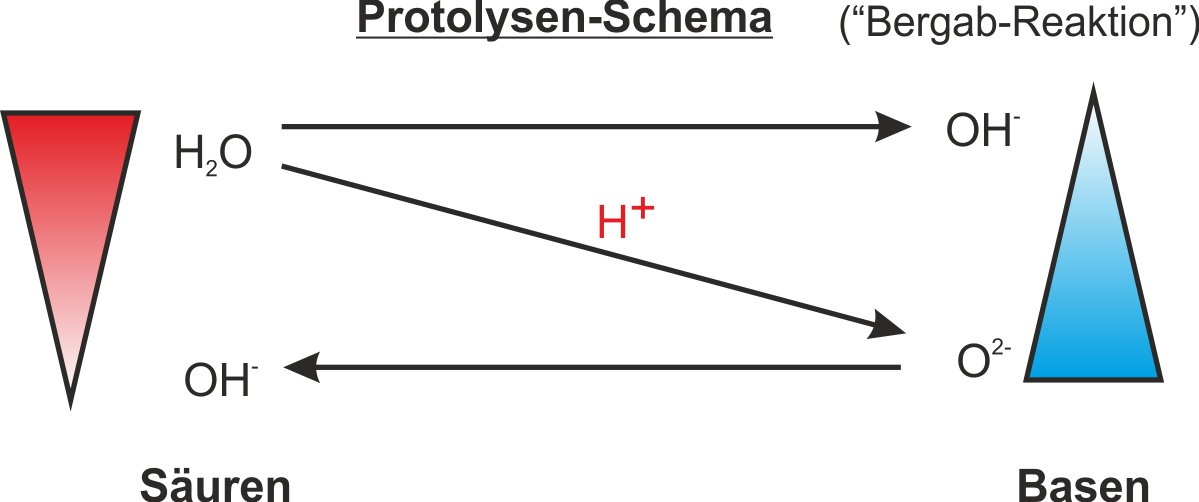
b) Erhitzen von Calciumhydroxid
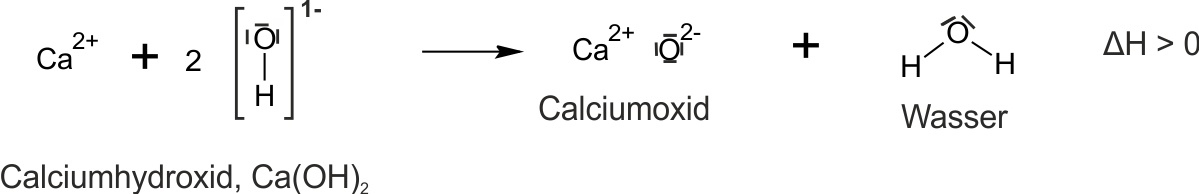
c) Bildung und Zerlegung von Calciumhydroxid
CaO + H₂O ⇄ Ca(OH)₂
Calciumoxid Wasser Calciumhydroxid
- Details
- Geschrieben von: Wolfram Hölzel
2 Gleichgewichte
2.1 Schwefelsäure – Wasserdampf – Gleichgewicht
a) konzentrierte Schwefelsäure (H2SO4)
- enthält Schwefelsäuremoleküle
- zeichnet einmal die Strukturformel(n) (unter Berücksichtigung, dass die Edelgas-Regel erfüllt sein muss):
{slider title="Lösung" open="false" class="icon"}
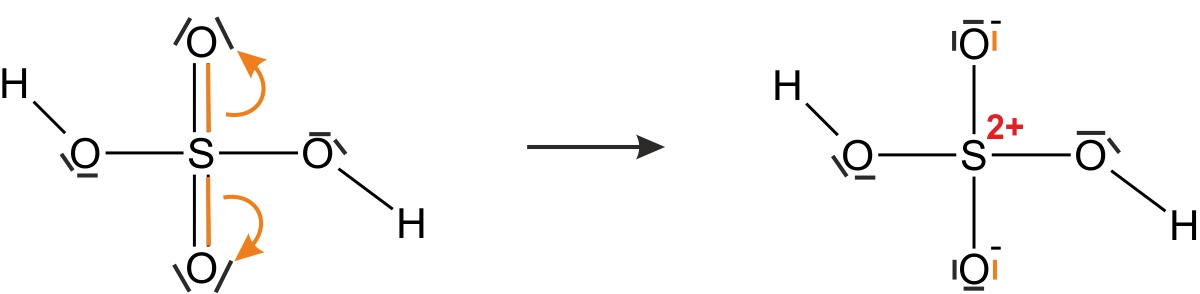
{/sliders}
- Konzentrierte Schwefelsäure ist geruchlos;
- Siedetemperatur beträgt 300°C;
- Konzentrierte Schwefelsäure reagiert heftig mit Wasser und Ionenbildung (Protolyse-Reaktion)
Formuliert für die Reaktion der Schwefelsäure mit Wasser in zwei Stufen die Reaktionsgleichung in Summenformeln
{slider title="Lösung" open="false" class="icon"}
H2SO4 + H2O → HSO4- + H3O+
HSO4- + H2O → SO42- + H3O+
{/sliders}
b) Verdünnte Schwefelsäure
Verdünnte Schwefelsäure enthält folgende Ionen und Moleküle; nennt diese:
{slider title="Lösung" open="false" class="icon"}
- H3O+ (Oxonium-Ion; früher Hydronium-Ion oder „Hydroxonium-Ion“)
- HSO4- (Hydrogensulft-Ion)
- SO42- (Sulfat-Ion; wenig)
- H2O Enthält viele Wassermoleküle
{/sliders}
2.2 Langzeitversuch: Konzentrierte Schwefelsäure
Versuchsdurchführung: In einen Zylinder 1 werden 100 ml konzentrierte Schwefelsäure gegeben. In einen Zylinder 2 werden zunächst 900 ml Wasser und dann vorsichtig 100 ml konzentrierte Schwefelsäure gegeben. Beide Zylinder werden mehrere Jahre offen im gleichen Zimmer stehengelassen.
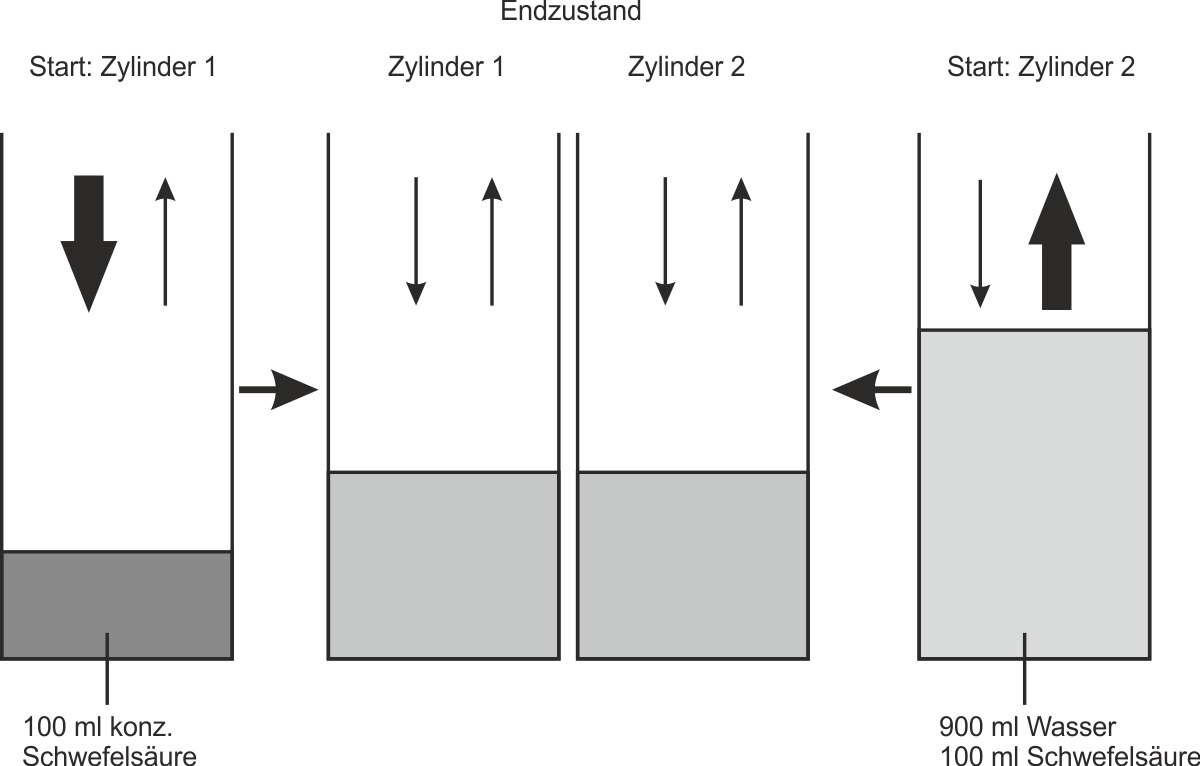
Versucht eine Deutung dieses Versuches:
{slider title="Lösung" open="false" class="icon"}
• Zylinder 1 nimmt mehr H2O -Moleküle aus der Umgebung auf als er abgibt.
• Zylinder 2 gibt mehr H2O -Moleküle an die Umgebung ab, als er aufnimmt.
• Nach einigen Jahren hat sich ein Gleichgewichtszustand eingestellt: Pro Zeiteinheit werden nun gleich viel H2O-Moleküle an die Umgebung abgegeben wie H2O-Moleküle in die Lösung hinzukommen.
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
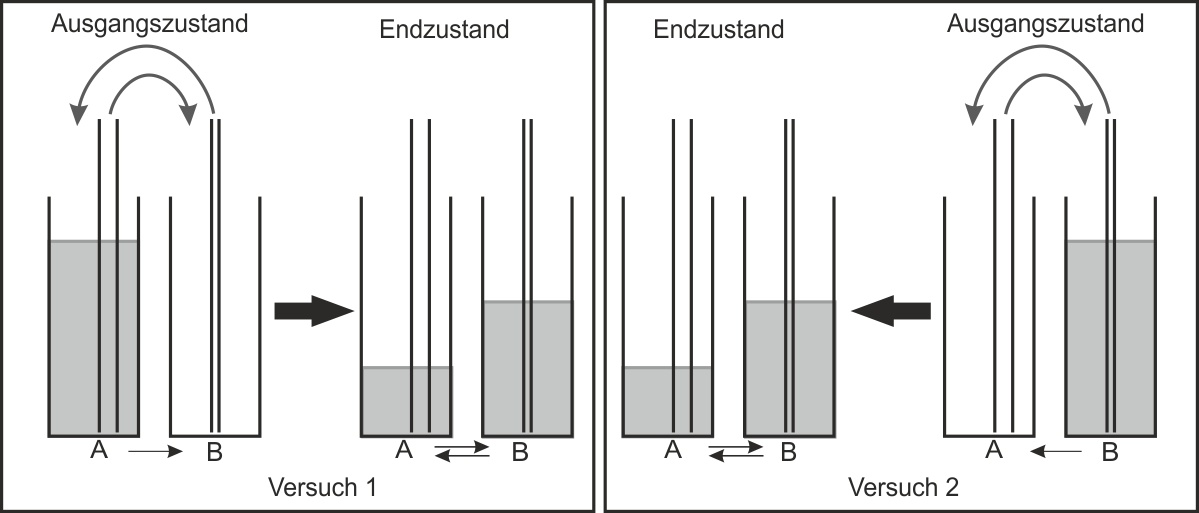
2.3 Modellexperiment - Stechheberversuch
Vergleiche dazu auch das ausgeteilte Arbeitsblatt zum Experiment.
Versuch 1: Flüssigkeit gelangt von A nach B. Die reversible Reaktion setzt mit der „Hinreaktion“ ein.
Anschließend gelangt auch Flüssigkeit von B zurück nach A. Es findet also auch eine „Rückreaktion“ statt. Nach einiger Zeit sind die in den Rohren im gleichen Takt beförderten Flüssigkeitsportionen gleich groß geworden.
Wie könnten die Endzustände bei den Experimenten 1 und 2 ausschauen?
{slider title="Lösung" open="false" class="icon"}
Versuch 1 und 2 führen zum gleichen Ergebnis („Gleichgewichtszustand“)
{/sliders}
Was für ein Diagramm bekommt man, wenn man das Volumen in den Standzylindern gegen die Zeit aufträgt? Und wie sieht das Diagramm aus, wenn man das Volumen innerhalb der Pipetten/Glasrohre gegen die Zeit aufträgt?
{slider title="Lösung" open="false" class="icon"}
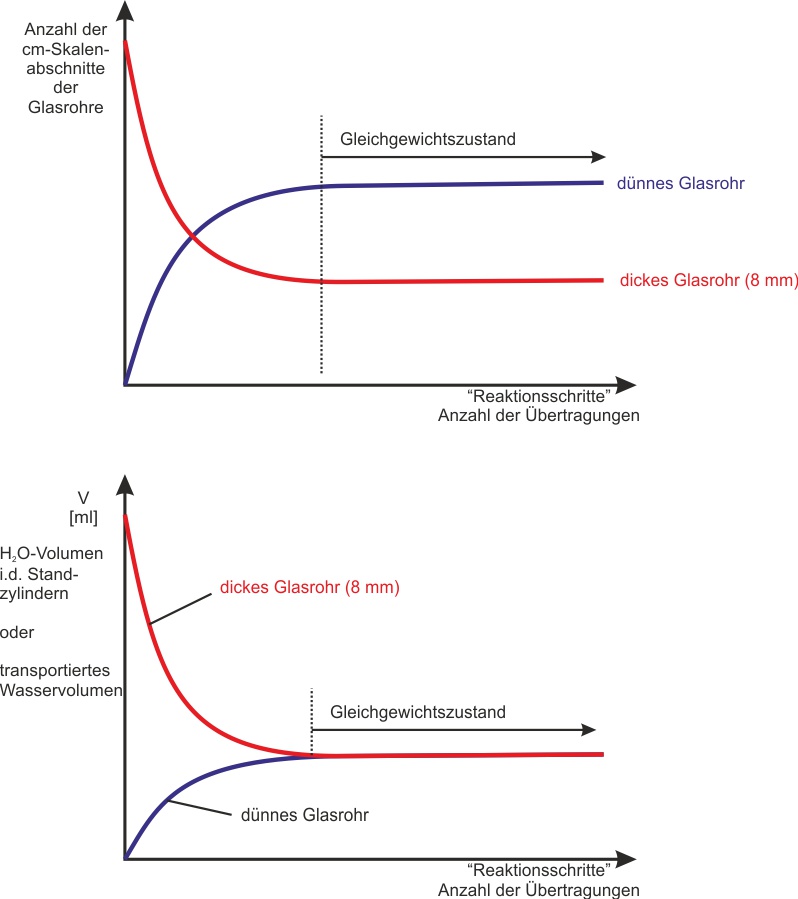
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
2.4 Merkmale eines chemischen Gleichgewichts
Wichtig:
|
Wiederholung: System-Begriff
| Offenes System | Geschlossenes System | Abgeschlossenes System (= isoliertes System |
|
| Austausch von.... | + Energie + Teilchen |
+ Energie | -- |
| Kein Austausch von .... | - Teilchen | - Energie - Teilchen |
|
|
|||
| idealisierte Beispiele | "Kochtopf" Mensch |
"Dampfkochtopf" Reagenzglas mit Stopfen |
"Thermoskanne" Universum |
- Details
- Geschrieben von: Wolfram Hölzel