7 Pufferlösung
Eine Pufferlösung hält ihren pH-Wert bei Zusatz von nicht zu viel Oxonium-Ionen bzw. Hydroxid-Ionen ziemlich konstant.
Eine Pufferlösung enthält:
- Eine Base, die zugesetzte H₃O⁺ -Ionen weg fängt.
- Eine Säure, die zugesetzte OH⁻-Ionen weg fängt.
Bedingung: Es dürfen sich Säure und Base nicht gegenseitig unwirksam machen.
Bsp.: Acetatpuffer
Man mischt gleiche Volumina Essigsäure (HAc) und Natriumacetatlösung (Na¹⁺ Ac⁻) derselben Konzentration (gleiche Stoffmenge liegt vor). Der pH-Wert dieser Pufferlösung beträgt 4,7.
I) Pufferwirkung
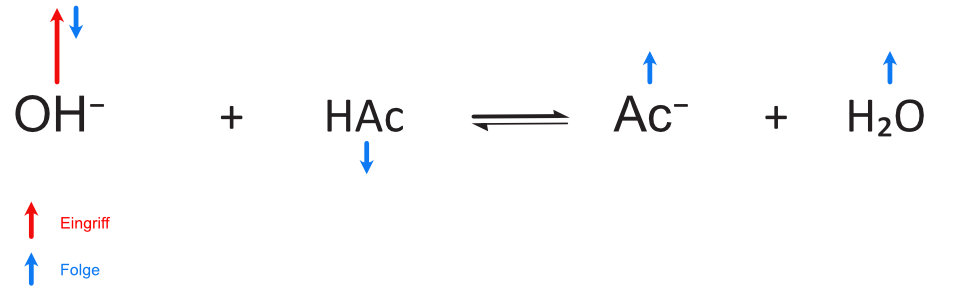
a) Zusatz von Oxonium-Ionen:
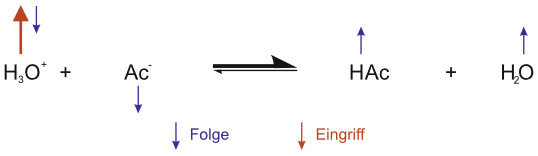
b) Wie sieht es nun bei Zusatz von Hydroxid-Ionen aus?
{slider title="Lösung" open="false" class="icon"}
{/sliders}
Wenn genügend Ac- (HAc) vorhanden sind, reagieren die zugesetzten Oxonium-Ionen (Hydroxid-Ionen) zum größten Teil. Dadurch ändert sich das Mengenverhältnis von HAc und Ac⁻.
II) Änderung des pH-Wertes bei Änderung des Mengenverhältnisses HAc : Ac⁻:
HAc + H₂O ⇌ H₃O⁺ + Ac⁻
Herleitung der Henderson-Hasselbalch-Gleichung:
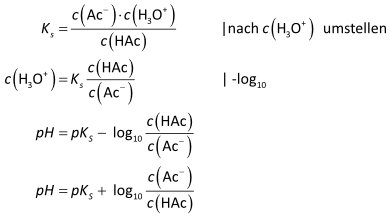
Beim Mengenverhältnis HAc : Ac- = 1 : 1 ist c(H₃O⁺) = KS, also pH = pKS.
Gute Pufferwirkungen besteht nur, wenn das Konzentrationsverhältnis von Säure (HAc) und Base (Ac⁻) nicht größer als 1:10 oder 10:1 ist, also innerhalb des pH-Bereichs: pH = pKS ± 1.
7.1 Puffersysteme bei Menschen
Ohne Puffer würden bereits kleinste Mengen Säure z.B. Laktat genügen, um den Organismus lahm zu legen, indem Proteine (z.B. rote Blutkörperchen oder Enzyme) denaturiert und unbrauchbar gemacht werden.
pH-Wert im Blut: pH 7,35 und 7,45 Letal nach kurzer Zeit: pH < 7,0 und > 7,7
Im Überblick:
Hydrogencarbonat/Kohlensäure HCO₃⁻ / H₂CO₃
Hämoglobin“-„/Hämoglobin
Proteinat/Protein
Hydrogenphosphat/Dihydrogenphosphat HPO₄²⁻ / H₂PO₄¹⁻
(I) Hydrogencarbonat/Kohlensäurepuffer
Formuliere für die Kohlensäure/Hydrogencarbonat-Puffer die Reaktionsgleichung:
Bsp.: Blut wird alkalischer:
{slider title="Lösung" open="false" class="icon"}
H₂CO₃ + OH⁻ ⇌ HCO₃⁻ + H₂O
{/sliders}
Blut wird sauer
{slider title="Lösung" open="false" class="icon"}
HCO₃⁻ + H₃O⁺ ⇌ H₂CO₃ + H₂O ⇌ H₂O + CO₂ + H₂O
CO₂ wird abgeatmet.
{/sliders}
⇨ Blut wird alkalisch ⇨ vermindertes abatmen (Hypoventilation) ⇨ mehr CO₂ bleibt im Blut
⇨ Blut wird sauer ⇨ vermehrtes abatmen (Hyperventilation) ⇨ mehr CO₂ wird abgegeben.
⇨ Blut wird sauer: H₃O⁺ + NH₃ ⇌ NH₄⁺ + H₂O ⇨ Ausscheidung