3 Alkine
3.1 Ethin (Acetylen)
3.1.4 Funktionsweise von Carbidlampen
3.2 Reaktionstyp bei Alkinen mit Übungen
- Details
- Geschrieben von: Wolfram Hölzel
3.1 Ethin (Acetylen)
3.1.1 Eigenschaften
a) physikalische Eigenschaften
- farbloses Gas (geruchslos)
- leichter als Luft
- Smp.: -80,8°C
- Sdp.: - 84°C (Sublimation)
b) chemische
- brennt mit stark leuchtender und rußender Flamme
- entfärbt Bromwasser
- bildet mit Luft ein explosives Gemisch
- zerfällt unter Druck explosionsartig (⇨ nicht in Druckflaschen)
3.1.2 Formelermittlung
Verbrennungsprodukte: H₂O, CO₂ (und bei unvollständiger Verbrennung C)
Molare Masse: M(Ethin) = 26 g/mol
Ermittel aus der molaren Masse die Summen- und die Strukturformel:
{slider title="Lösung" open="false" class="icon"}
Summenformel: C₂H₂
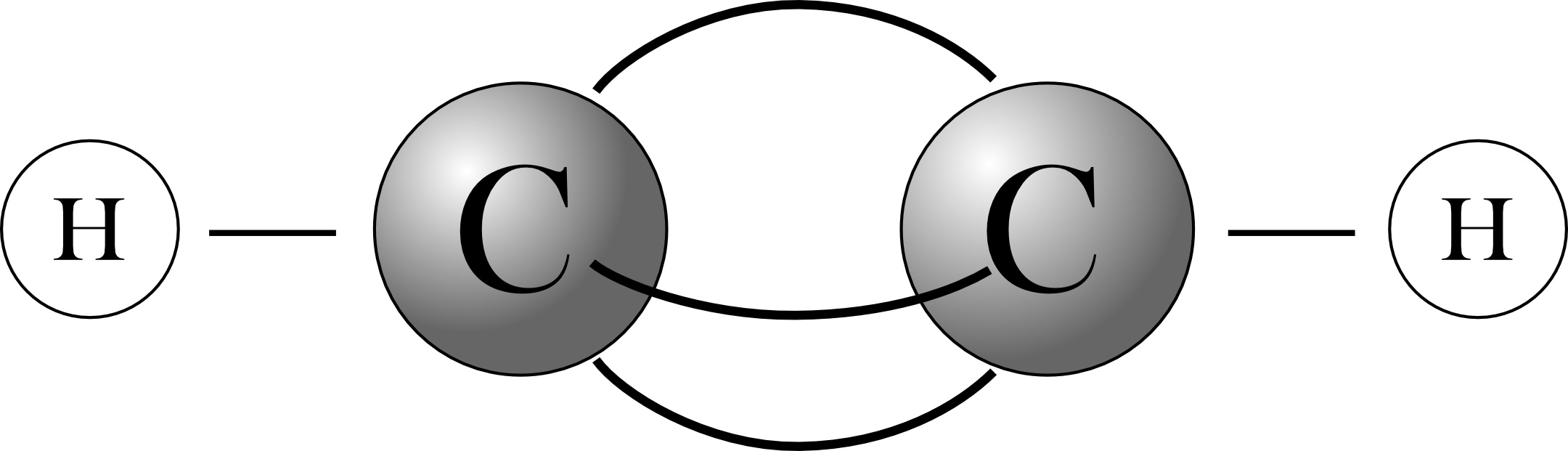
Strukturformel:
(linear; Bindungswinkel 180°)Bindungslänge noch geringer als bei der Doppelbindung (C=C: 134 pm; C=-C: 120 pm)
Ballmodell:
3 „Bananenbindungen“, alle 4 Atome sind linear angeordnet.
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
3.1.3 Herstellung
- Wasser wird auf Calciumcarbid (CaC₂) getropft (vgl unten)
- Cracken von Erdöl
3.1.4 Funktionsweise von Carbidlampen
Gewinnung von Calciumcarbid aus Kohle und Kalkstein;Technisch wird Calciumcarbid im Lichtbogenofen bei 2500 °C aus Calciumoxid (Branntkalk) und Koks gewonnen, so dass die Herstellung durch den hohen Stromverbrauch sehr kostenintensiv ist.
a) Bildung von Calciumcarbid:
Im Lichtbogenofen (2500 °C) aus Calciumoxid und Koks (C) gewonnen. Dabei entsteht CO.
Aufgabe: Formulierte die Reaktionsgleichung für die Bildung:
{slider title="Lösung" open="false" class="icon"}
CaO + 3 C → CaC₂ + CO
{/sliders}
b) Bildung von Ethin (Auftropfen auf Calciumcarbid):
Calciumcarbid + Wasser → Ethin + Calciumhydroxid ΔH < 0
CaC₂ ist eine Ionenverbindung: Ca²⁺ + C₂²⁻
Formuliert hier die Reaktionsgleichung mit bindenden und nichtbindenden Elektronenpaare (Lewis/Strukturformel):
{slider title="Lösung" open="false" class="icon"}
{/sliders}
c) Verbrennung von Ethin
Stark Exotherm (Temp. Über 3000 °C ⇨ Eisen und Stahl schmilzt).
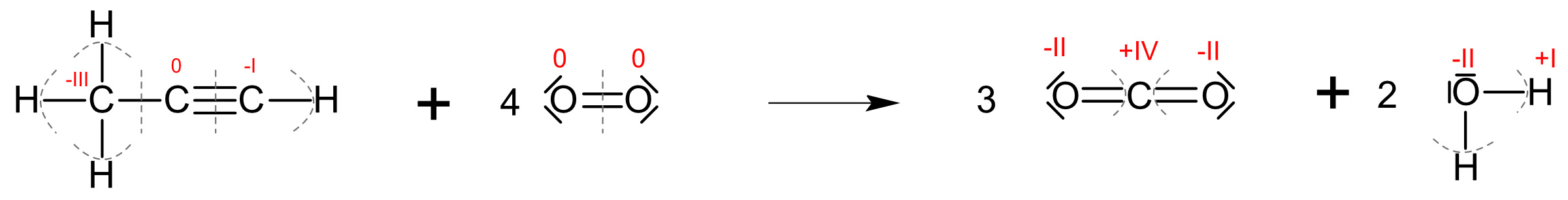
Aufgabe: Eine vollständige Verbrennungsreaktion müsste jetzt keine Schwierigkeiten mehr bereiten. Formuliere die vollständige Verbrennung in Strukturformelschreibweise und ergänze diese mit Oxidationszahlen.
{slider title="Lösung" open="false" class="icon"}
{/sliders}
3.1.5 Verwendung
- Autogenes Schweißen (vgl. Verbrennungsreaktionsgleichung)
- Wichtiger Grundstoff für Synthesen
- Details
- Geschrieben von: Wolfram Hölzel
3.2 Reaktionstyp bei Alkinen
Wie bei Doppelbindungen ⇨ Additionsreaktionen
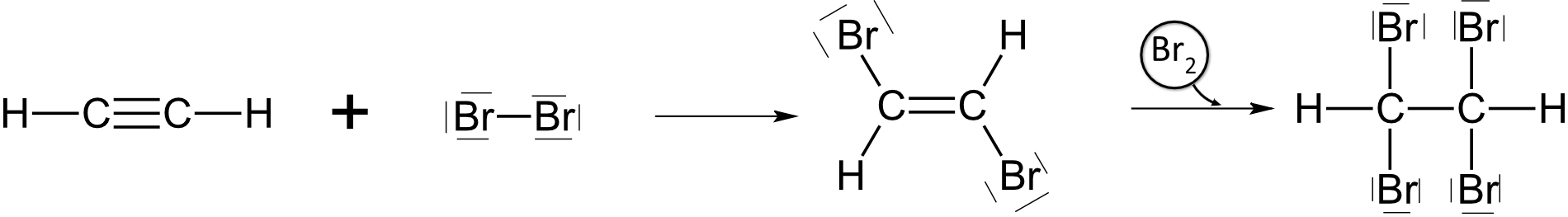
a) Addition von Halogene
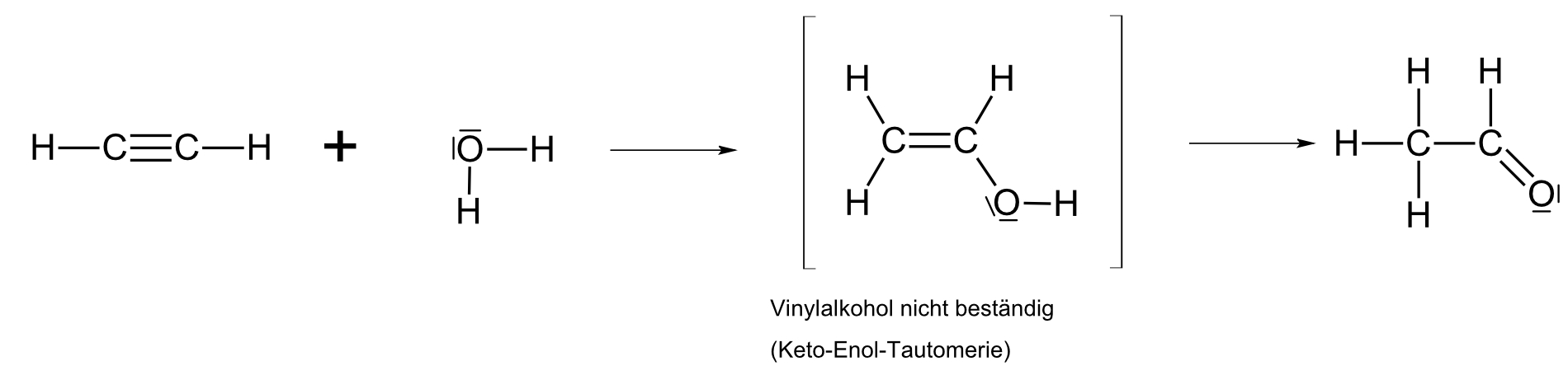
b) mit Wasser
Es gibt viele weitere Reaktionen, die technisch genutzt werden.
Überungsaufgaben
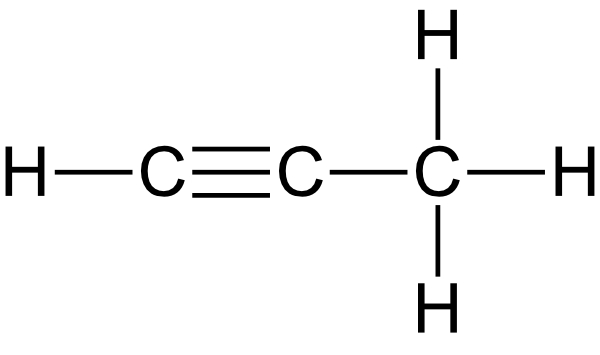
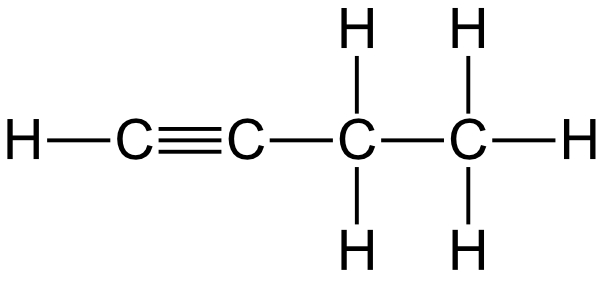
1. Gib alle möglichen Strukturformeln von Propin und Butin an (nur eine Mehrfachbindung).
{slider title="Lösung" open="false" class="icon"}
Propin:
Butin:
2-Butin oder But-2-in
1-Butin oder But-1-in
{/sliders}
2. Formuliere die Reaktionsgleichungen für
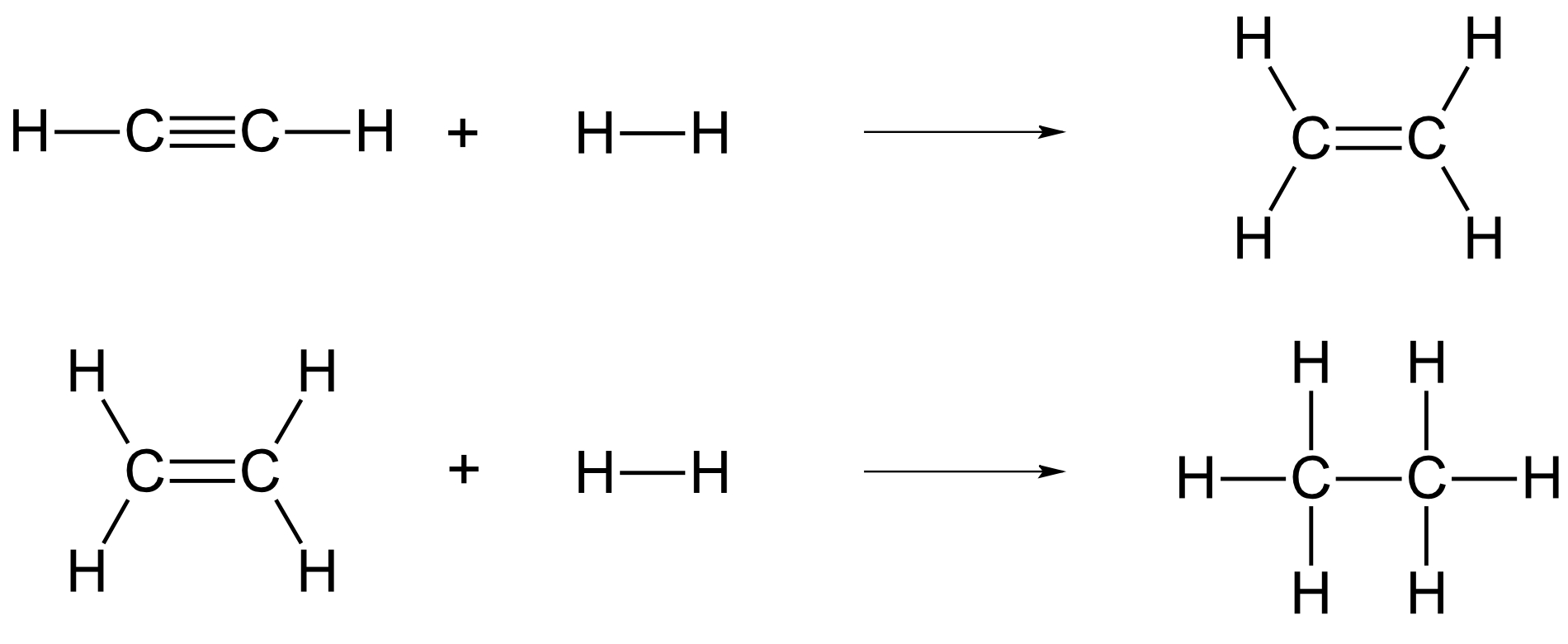
a) die Reaktion von Ethin zu Ethen und dann zu Ethan;
{slider title="Lösung" open="false" class="icon"}
{/sliders}
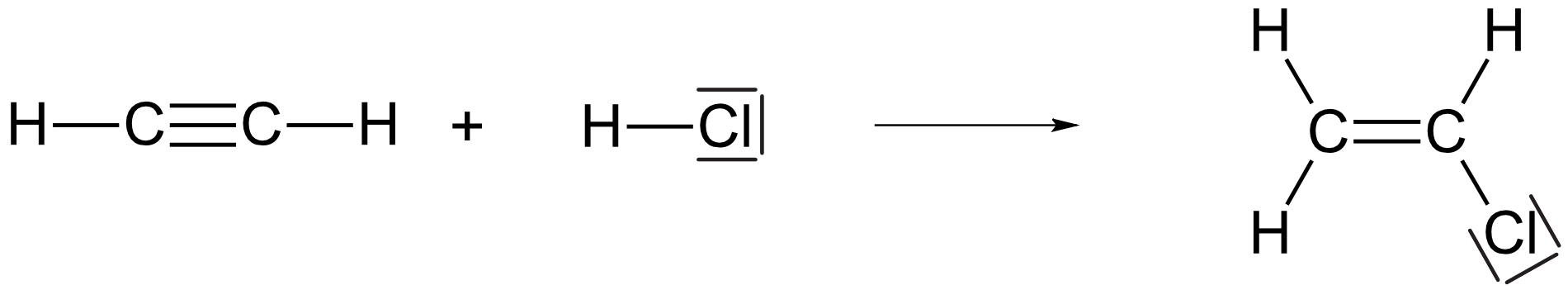
b) die Herstellung von Chlorethen aus Ethin.
{slider title="Lösung" open="false" class="icon"}
{/sliders}
3. Bei Alkenen findet man die cis-trans-Isomerie. Gibt es das auch bei Alkinen?
{slider title="Lösung" open="false" class="icon"}
Nein, da an den beiden C-Atomen der C-C-Dreifachbindung sich nur je ein Atom/Atomgruppe befindet und der Bindungswinkel 180° beträgt. Es gibt somit keine "gegenüberliegende" Seite.
{/sliders}
4. Ethin wird heute vorwiegend durch unvollständige Verbrennung von Methan hergestellt. Formuliere die Reaktionsgleichung als Summenformel.
{slider title="Lösung" open="false" class="icon"}
4 CH₄ (g) + 3 O₂ (g) → 2 C₂H₂ (g) + 6 H₂O (g)
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel