Was ist Chemie?
ägyp. für ch’mi = schwarz
Chemie ist eine Naturwissenschaft.
Chemie ist die Lehre von den Stoffen, ihrem Aufbau, ihren Eigenschaften und ihren Reaktionen.
1 Stoffe und ihre Eigenschaften
1.1 Körper und Stoff
Körper: Die Gegenstände unserer Umwelt heißen Körper. Jeder Körper hat eine bestimmte Masse und nimmt einen Raum ein.
Stoff: nennt man das Material, aus dem die Körper bestehen.
1.2 Eigenschaften der Stoffe
a) Eigenschaften können z.T. mit den Sinnen erfasst werden; z. B.
• Aussehen (Farbe, Oberflächenglanz, Kristallform)
• Geruch
• Geschmack
b) Eigenschaften können z.T. auch mit Geräten gemessen werden; z.B.
• Elektrische Leitfähigkeit
• Schmelztemperatur, Siedetemperatur
• Härte
c) Weitere Eigenschaften z.B.
• Löslichkeit
• Magnetismus
• Wärmeleitfähigkeit
• Brennbarkeit
• Dichte
1.2.1 Dichte und Dichtebestimmung

Die Dichte, Formelzeichen: ρ (griechisch: Rho), ist eine physikalische Eigenschaft eines Materials.
Die Dichte ist eine Stoffkonstante und unabhängig vom Ort. Die Dichte ist dagegen abhängig von Temperatur und Druck
a) Bestimmung der Dichte von Flüssigkeiten (bei Zimmertemperatur)
[Schülerexperiment: Dichtebestimmung von Alkohol und Wasser]
1. Schritt: Das Volumen wird mit dem Messzylinder ermittelt.
Hinweis zum Ablesen der Höhe einer Flüssigkeit in einem Messzylinder:
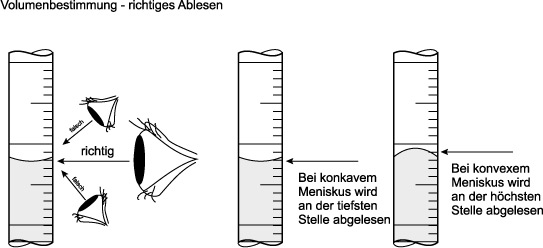
2. Schritt: Durch Wägung wird die Masse der Stoffportion bestimmt.
3. Schritt: Rechnung
Ergebnis: Die Dichte beträgt bei Wasser etwa 1 g/cm³, von Ethanol ca. 0,79 g/cm³.
b) Bestimmung der Dichte von Feststoffen
[Schülerexperimente: Dichtebestimmung von Kupfer und Eisen]
1. Schritt: Bestimmung der Masse der Stoffportion (mit Waage)
2. Schritt: Bestimmung des Volumens (Wasserverdrängung mit Messzylinder)
3. Schritt: Rechnung (Einsetzen der experimentell gefundenen Werte)
Ergebnis: Die Dichte beträgt bei Kupfer 8,93 g/cm³ und bei Eisen 7,87 g/cm³.
c) Bestimmung der Dichte von Gasen (bei Zimmertemperatur)
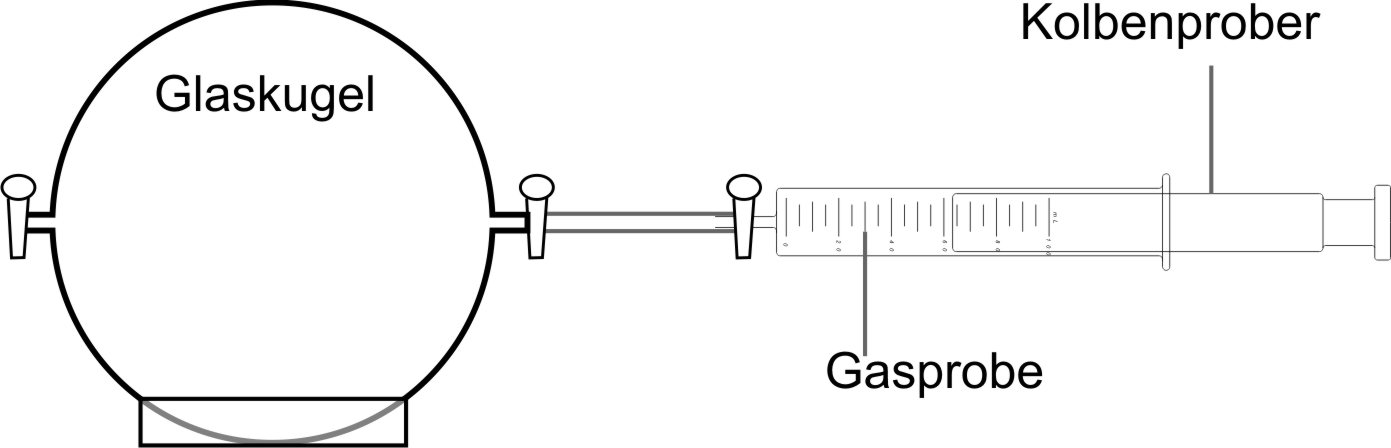
Apparatur zur Dichtebestimmung von Gasen:
Eine Gaswägekugel wird mit der Wasserstrahlpumpe weitgehend luftleer gepumpt und gewogen. Mit Hilfe eines Kolbenprober wird eine Gasportion mit bekannten Volumen (100 ml) in die Gaswägekugel eingesaugt. Die mit 100 ml Luft gefüllte Kugel wird erneut gewogen. Aus der Massenzunahme und dem Volumen (100 ml) wird die Dichte der Luft berechnet.
Ergebnis: Bei 20°C und Normdruck 1013 hPa beträgt die Dichte (g/cm³) von Luft 0,00129.
Übungsaufgaben
1.) Für 1 kg Spiritus benötigt man eine Flasche mit einem Inhalt von 1,264 L. Berechne die Dichte von Alkohol.
Lsg: 0,7913 g/cm³ Um die Lösung zu sehen, müsst ihr den Text hinter der Lösung markieren.
2.) Welches Volumen muss ein Heliumballon besitzen, um 1 kg Helium aufnehmen zu können. Dichte von Helium: ρ = 0,000178 g/cm³
Lsg: 5 617 L
3.) Im Entwicklungsbüro von Daimler überlegt man sich, ob man in einer neuen Modellreihe den Fahrzeugunterbau statt aus Eisen aus Aluminium herstellen sollte. Das Volumen der zu ersetzenden Teile beträgt insgesamt 50 l. Wie groß wäre die Gewichtsersparnis?
Dichte von Eisen: ρ = 7,9 g/cm³,
Dichte von Aluminium: ρ = 2,7 g/cm³
Lsg: m(Fe) = 395 kg; m(Al) = 135 kg; Gewichtsersparnis: 260 kg
4.) Bankräuber leeren einen Tresor, der mit Goldmünzen gefüllt ist. Sie verstauen das Gold in eine Reisetasche mit folgender Abmessung: Länge: 0,9 m, Breite: 45 cm, Höhe: 38 cm. Sie füllen die Tasche ganz voll und lassen die restlichen Münzen zurück. Wie schwer ist der Inhalt der Tasche?
Dichte von Gold: ρ = 19,3 g/cm³
Lsg: m = 2 970 kg
5.) Wie schwer wäre die Tasche, wenn sie anstatt mit Gold mit Magnesium gefüllt wäre?
Dichte von Magnesium: ρ = 1,74 g/cm³
Lsg: m = 268 kg
c) Weitere Eigenschaften z.B.br /
- Details
- Geschrieben von: Wolfram Hölzel
1.3 Atommodelle:
1.3.1 Demokrit (400 vor Chr.; Athen):
- Atome sind die kleinsten, unteilbare Einheiten
1.3.2 Kugelteilchenmodell (KTM), Kugelmodell (John Dalton, 1803)
Jeder Stoff ist aus kleinsten Teilchen aufgebaut, die nicht sichtbar gemacht werden können.
Man benutzt deshalb eine Modellvorstellung: das Kugelteilchenmodell. Für die kleinsten Teilchen gilt:
a) sie sind kugelförmig und unteilbar;
b) jeder Reinstoff besitzt für ihn charakteristische Teilchen mit bestimmter Masse und Größe;
c) zwischen den Teilchen tritt leerer Raum auf;
d) zwischen den Teilchen wirken Anziehungskräfte;
e) die Teilchen sind ständig in Bewegung;
f) mit steigender Temperatur bewegen sich die Teilchen kräftiger.
Experiment:
Beobachtung:
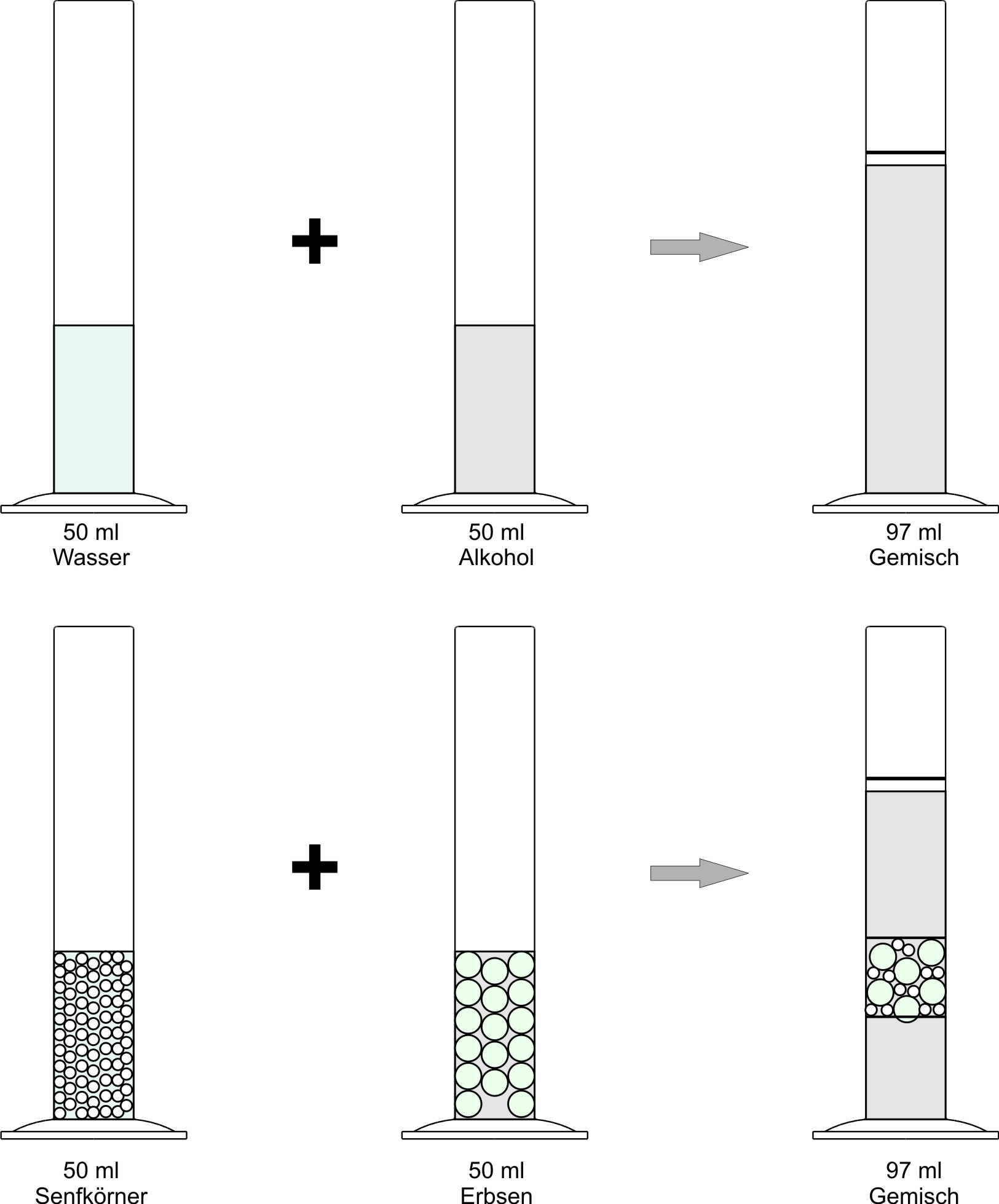
Bei der Mischung von Alkohol und Wasser ist das Gesamtvolumen der Mischung kleiner als die Summe der beiden Teilvolumina.
Hypothese:
Die kleineren kugelförmige Teilchen setzen sich in die Lücken der größeren kugelförmigen Teilchen (Bsp. Senf + Erbsen)
Beachte:
- Das Kugelteilchenmodell soll den Aufbau der Stoffe veranschaulichen.
- Das KTM ist keine Darstellung oder Kopie der Wirklichkeit.
- Das KTM erfasst nur wenige Aspekte der Wirklichkeit.
- Jedes Modell in den Naturwissenschaften hat seine Grenzen; es ist mehr oder weniger brauchbar, je nachdem, wie viele Beobachtungen es vereinigt und Voraussagen es zulässt.
- Details
- Geschrieben von: Wolfram Hölzel
1.3.3 Kugelteilchenmodell und Aggregatzustände
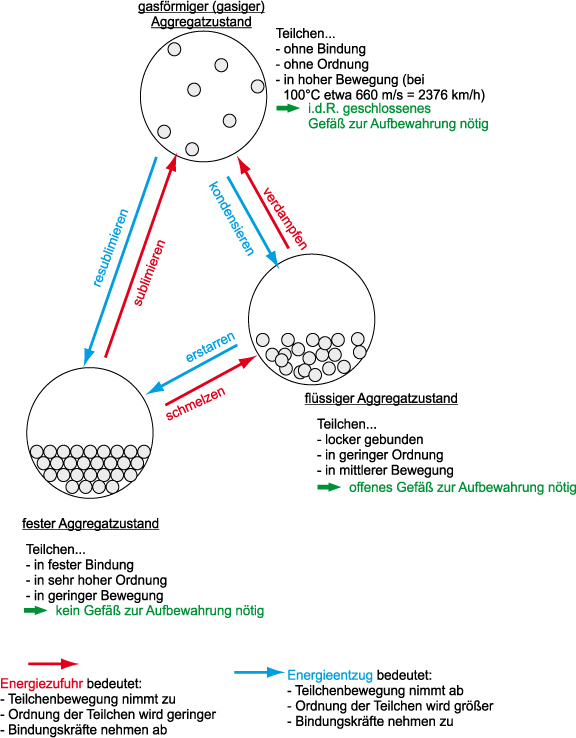
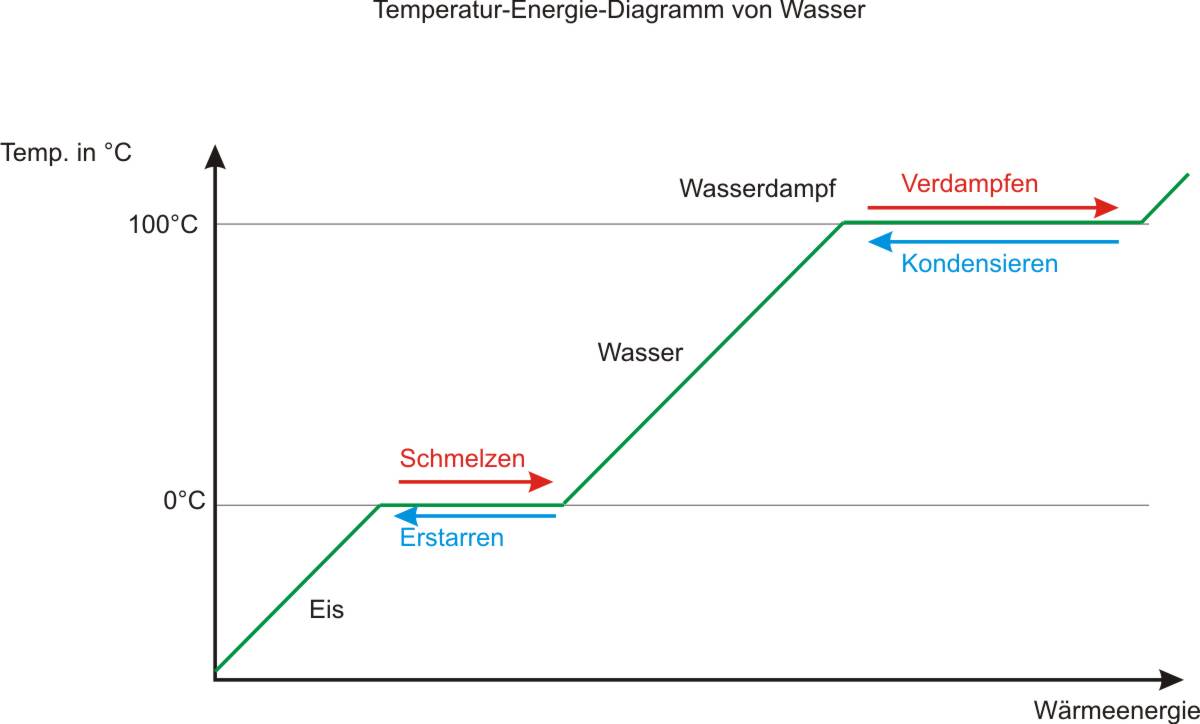
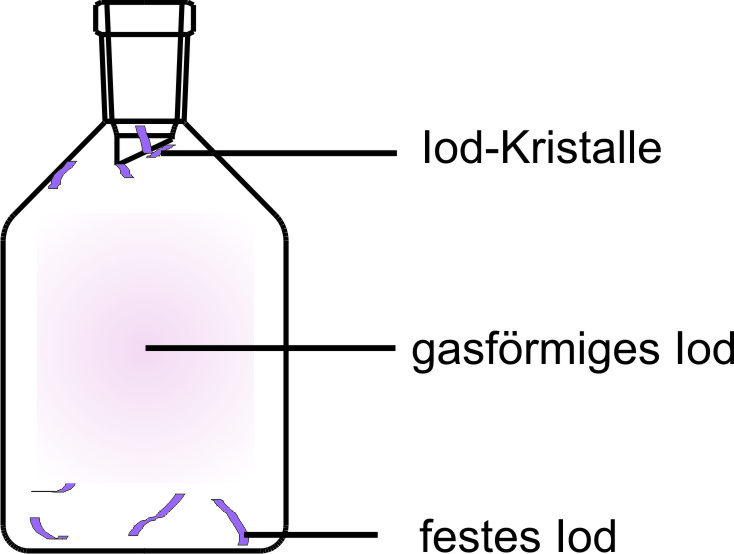
Sublimieren: Flasche mit Jod:
Über dem festen Jod befindet sich in der Flasche violetter Joddampf, aus dem sich langsam an den Wänden Jodkristalle bilden.
Übergänge zwischen den Aggregatzuständen verlaufen manchmal erst nach einem gewissen „Anstoßen“.
- „Siedeverzug“: beim Sieden (oft fast explosionsartig);
- „Unterkühlung“ beim Auskristallisieren aus einer Schmelze;
- „Übersättigung“ beim Auskristallisieren aus einer heißen gesättigten Lösung.
border=„Siedeverzug“: beim Sieden (oft fast explosionsartig);
- Details
- Geschrieben von: Wolfram Hölzel
1.4 Brownsche Molekularbewegung
Versuch 1:
Durchführung:
1. Schritt: Vollmilch und Wasser wird im Verhältnis 1:1 vermischt.
2. Schritt: 1 Tropfen wird auf dem Objektträger gegeben und mit einem Deckgläschen bedeckt.
3. Milch-Wasser-Tropfen wird mikroskopiert.
Beobachtung: Die Fetttropfen bewegen sich (zittern).
Ergebnis:
Brownsche Molekularbewegung: Bewegung, die die Teilchen in allen Aggregatzuständen (fest, flüssig, gasförmigen) ausüben.
1.5 Diffusion
vgl. Versuche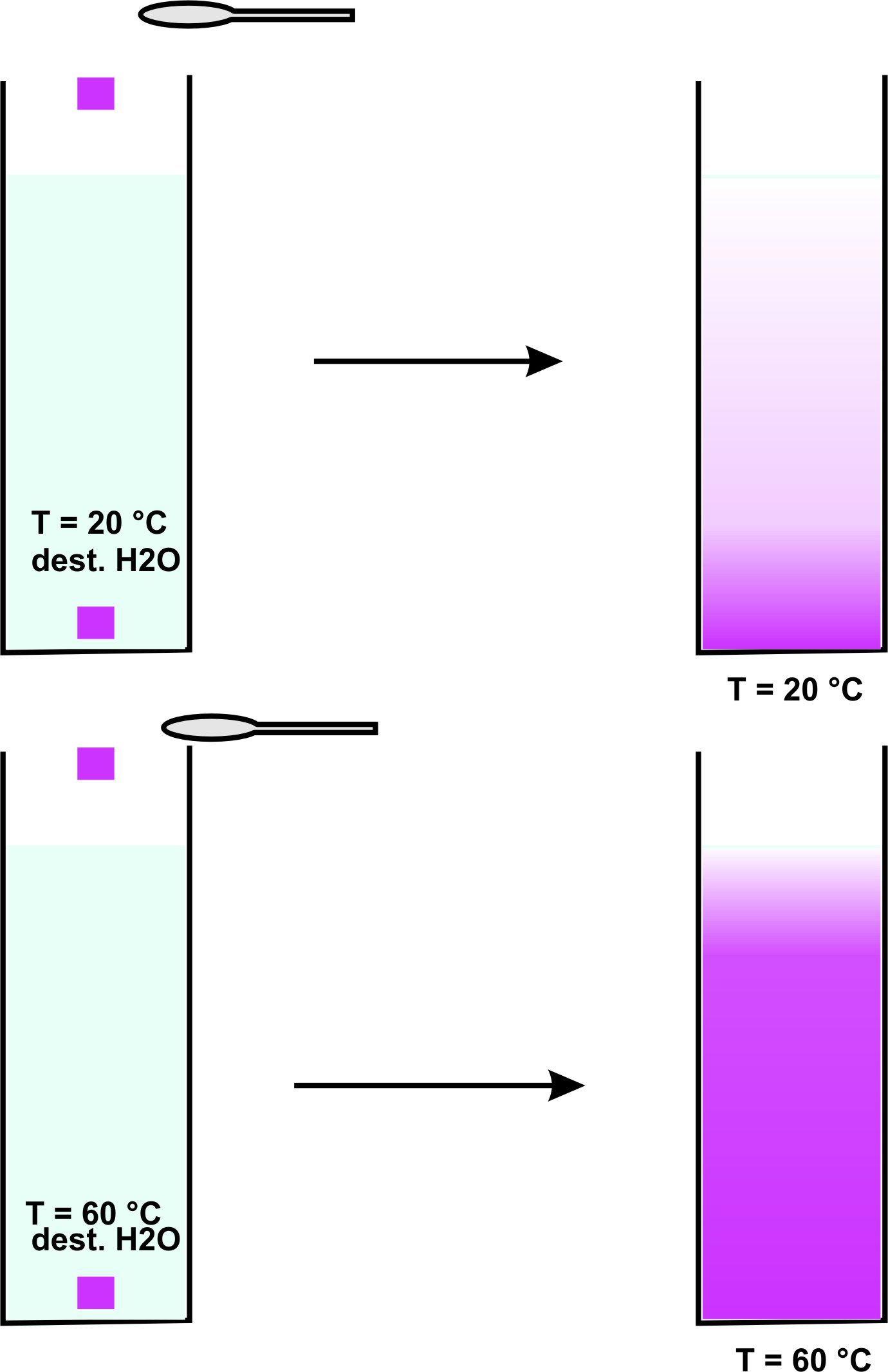
Beobachtung:
Die Kristalle lösen sich unter Schlierenbildung auf. Mit der Zeit verteilen sich die Ionen (= geladene Teilchen) gleichmäßig.
Dabei läuft die Verteilung im warmen Wasser schneller ab als im kalten.
Die Teilchengeschwindigkeit ist umso höher, je höher die Temperatur ist.
Die Diffusion erfolgt umso schneller, je
- höher die Temperatur
- kleiner die Teilchen
- kürzer die Strecke
Diffusion ist in einem Gas schneller als in einer Flüssigkeit.
1.6 Löslichkeit
Flüssigkeiten (z.B. Wasser, Brennspiritus), die Stoffe (z.B. Zucker, Kaliumnitrat) lösen, heißen Lösungsmittel. Gelöst werden können Feststoffe, Flüssigkeiten und Gase. Ein Lösungsmittel kann nicht jeden Stoff lösen. Nimmt die Lösung keinen weiteren Stoff mehr auf, so ist die Lösung gesättigt.
• Leicht löslich: Lösungsmittel: 100 g Wasser, bei 20 °C: es lösen sich 204 g Zucker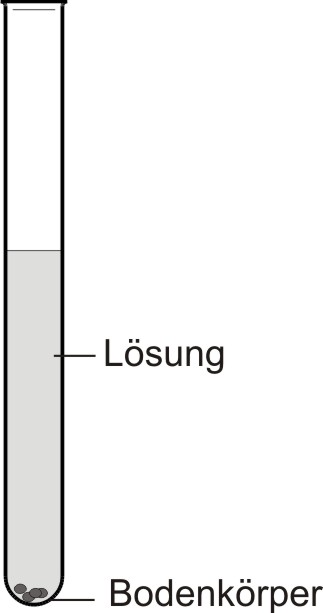
• Schwer löslich: Lösungsmittel: 100 g Wasser, bei 20 °C: es lösen sich 0,2 g Gips
• Bodenkörper: fester Stoff, der sich nicht weiter löst.
Bei vielen festen und flüssigen Stoffen nimmt die Löslichkeit mit steigender Temperatur zu.
Bei Gasen nimmt die Löslichkeit mit steigender Temperatur ab.
KTM-Erklärung für das Lösen von Zucker in Wasser:
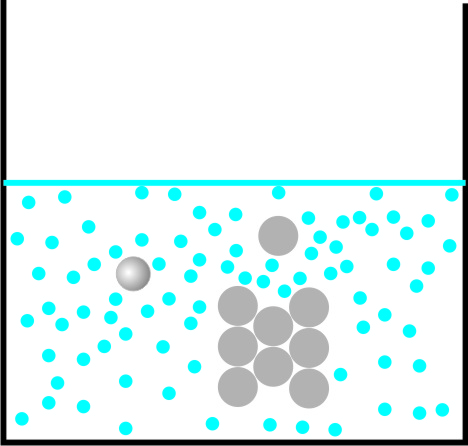
Die sich bewegende Wasserteilchen schieben sich zwischen die Zucker-Teilchen und lösen sie aus dem Kristall.
1.6.1 Kristalle
- Kristalle sind gekennzeichnet durch geometrisch regelmäßige Anordnung ihrer Außenflächen und Kanten. Kristalle sind immer durch Ebenen begrenzt.
Nichtkristalline (amorphe) Stoffe haben dagegen gekrümmte Flächen als Begrenzung (Bsp. Glas, Kunststoff) - Entstehung von Kristallen:
- aus heißgesättigten Lösungen durch Abkühlen (z.B. Kupfersulfat)
- aus kaltgesättigten Lösungen durch Verdunsten des Lösungsmittel [möglichst langsam] (z.B. Zucker)
- aus Dämpfen durch Erstarren
- aus Schmelzen durch Erstarren
- Details
- Geschrieben von: Wolfram Hölzel
Hier findet sich das erste Kapitel der Chemie der 8. Klasse. Folgende Nummerierungen können von der Heftnummerierung abweichen, weil ich bei Zeitmangel mal ein unwichtigeres Thema weggelassen oder ein aktuelles Thema dazu genommen habe. Für mögliche Konfusionen bitte ich jetzt schon um Entschuldigung.
1. Stoffe und ihre Eigenschaften
1.1 Körper und Stoff
1.2 Eigenschaften der Stoffe
1.2.1 Dichte und Dichtebestimmung Stoffe und ihre Eigenschaften
1.3 Atommodelle
1.3.1 Demokrit
1.3.2 Dalton: Kugelteilchenmodell (KTM) = Kugelmodell
1.3.3 Kugelteilchenmodell und Aggregatzustände
1.4 Brownsche Molekularbewegung
1.5 Diffusion
1.6 Löslichkeit
1.6.1 Kristalle
1.7 Stoffklassen
1.8 Reinstoffe
1.9 Gemische (Stoffgemische)
1.9.1 Heterogenes Gemisch
1.9.1 Heterogenes Gemisch
1.9.3 Trennverfahren zur Gewinnung von Reinstoffen
- Details
- Geschrieben von: Wolfram Hölzel
