12.1 Beispiele
a) Bildung von Chlorwasserstoff aus den Elementen
Chlorknallgasreaktion: H₂ (g) + Cl₂ (g) → 2 HCl (g)
ΔHf⁰ (H₂ (g)) = 0 kJ/mol
ΔHf⁰ (Cl₂ (g)) = 0 kJ/mol
ΔHf⁰ (HCl (g)) = - 92 kJ/mol
S° (H₂ (g)) = 131 J/(K ∙ mol)
S° (Cl₂ (g)) = 223 J/(K ∙ mol)
S° (HCl (g)) = 187 J/(K ∙ mol)
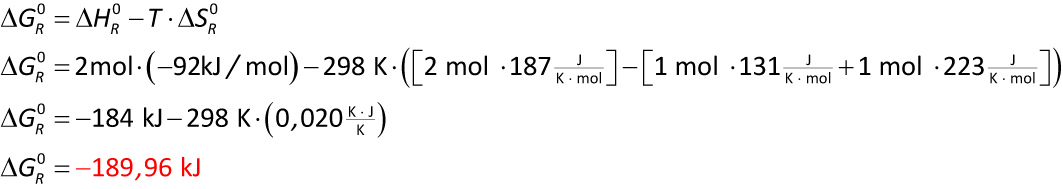
Zusammenfassung:
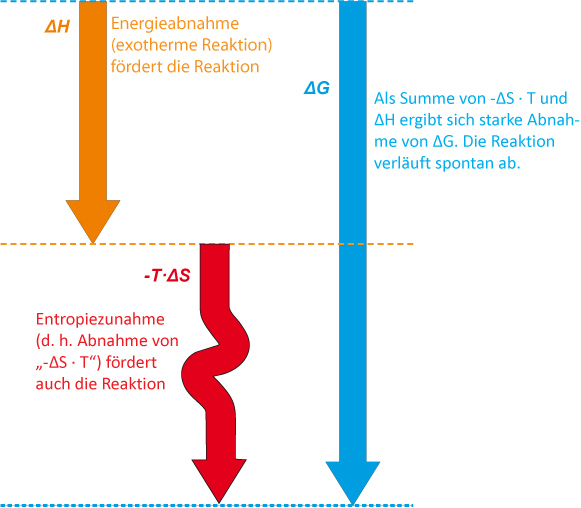
Bei der Bildung von Chlorwasserstoff aus den Elementen handelt es sich um eine exergonische Reaktion. Es wirken Enthalpie und Entropie zusammen.
Die Reaktion läuft spontan (freiwillig) ab.
b) Ammoniaksynthese aus den Elementen
N₂ + 3 H₂ → 2 NH₃
ΔHf⁰ (H₂ (g)) = 0 kJ/mol
ΔHf⁰ (N₂(g)) = 0 kJ/mol
ΔHf⁰ (NH₃ (g)) = - 46 kJ/mol
S° (H₂ (g)) = 131 J/(K ∙ mol)
S° (N₂ (g)) = 192 J/(K ∙ mol)
S° (NH₃ (g)) = 192 J/(K ∙ mol)
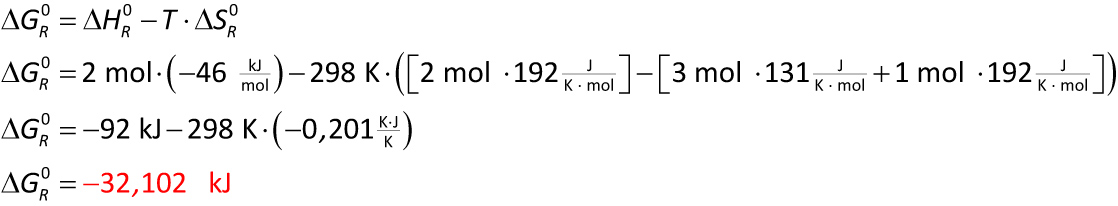
 Zusammenfassung:
Zusammenfassung:
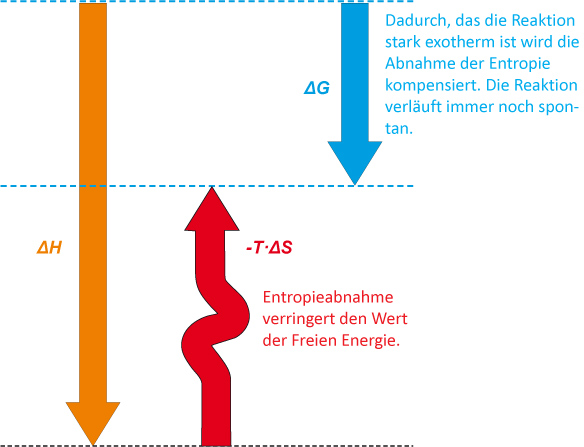
Die Abnahme der Enthalpie (ΔH) wirkt die Zunahme der Ordnung entgegen. Die Differenz zwischen ΔH und –T ∙ ΔS ist die Änderung der freien Enthalpie ΔG. Die Reaktion ist spontan (gehemmt), aber nicht in dem Maße, wie es sich allein aus der Enthalpieänderung ΔH ergäbe.
c) Zersetzung von N₂O₅ (Stickstoff(V)-Oxid)
Reaktionsgleichung:
![]()
ΔHf⁰ in kJ: -41,8 0 2 ∙ (+ 33,8) ΔHR⁰ = +109,4 kJ
S° in J/K 113,4 ½ ∙ 205 2 ∙ 240,5 S° = + 470,1 J/K
Eingesetzt in die Gibbs-Helmholtz-Gleichung:

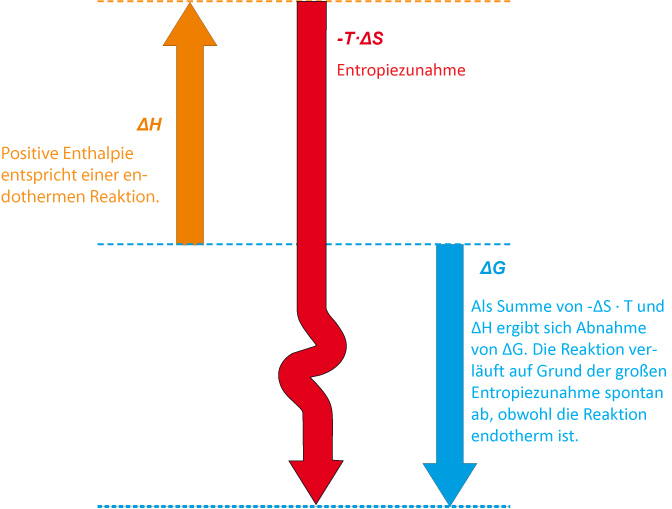 Zusammenfassung:
Zusammenfassung:
Bei der Zersetzung von festem Distickstoffpentoxid zu gasigem Sauerstoff und Stickstoffdioxid erhält man Produkte, die um 470 J/K ungeordneter sind. Obwohl es eine endotherme Reaktion ist, wird durch diesen hohen Entropieanstieg die Zersetzung begünstigt.
Die Zersetzung von festem Distickstoffpentoxid ist eine exergonische Reaktion.
