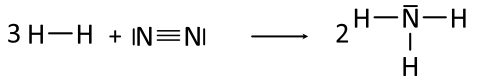4.1.1 Die Elektronenpaar-Bindung und die HNO-Regel
Die HNO-Regel hat leider ein paar Konsequenzen, die die Sache verkomplizieren. Wir werden immer wieder die gleichen chemischen Reaktionen anschauen, aber sie unterschiedliche Aufschreiben; wundert Euch also nicht, dass Euch manches bekantn vorkommt bzw. dass wir die Reaktionsgleichungen etwas unterschiedlich. Aber ihr wisst auch, dass man durch Wiederholung am besten lernt.
In diesem Kapitel geht es darum, zu verstehen, warum es eine einfache und eine etwas kompliziertere Reaktionsgleichung gibt, weil wir die HNO-Regel anwenden müssen.
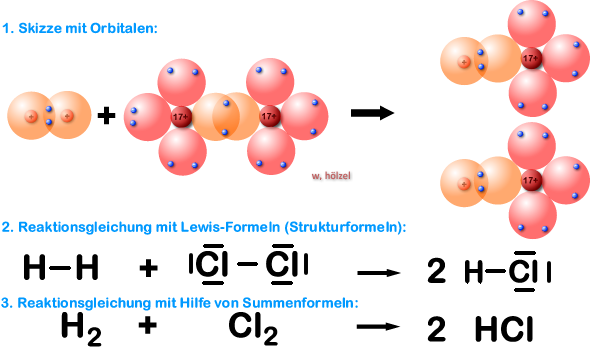
Beispiel 4a: Bildung eines Chlorwasserstoff-Moleküls, HCl-Molekül - ohne HNO-Regel.
Jetzt solltet ihr ein Molekül aus zwei unterschiedlichen Elementen herstellen (Element Wasserstoff und Element Chlor). Wir haben also ein Wasserstoff-Atom, welches mit einem Chlor-Atom reagieren soll. Das Ergebnis ist Chlorwasserstoff.
Im Chlorwasserstoff-Molekül liegt eine Einfachbindung vor; somit ist Chlor und Wasserstoff im Chlorwasserstoff-Molekül einbindig.
Im Chlorwasserstoff-Molekül erlangt das Chlor-Atom durch das gemeinsame (bindende) Elektronen-paar 8 Valenzelektronen (Edelgaskonfiguration, Oktett; Argon-Atom) und das Wasserstoff-Atom durch das binden-de Elektronenpaar 2 Außenelektronen (ebenfalls Edelgaskonfiguration; Helium-Atom) (siehe gestrichelte Kreise oben).
Bei den Ausgangsstoffen wird die Edelgas-Regel aber nicht erfüllt.
Beispiel 4b: Bildung eines Chlorwasserstoff-Moleküls, HCl-Molekül - mit HNO-Regel.
Frage: Für welche Ausgangsstoffe müssen wir die HNO-Regel anwenden?
{slider title="Lösung" open="false" class="icon"}
Für beide. H-Atom kommt in "HNO" vor und Cl-Atom ist ein "Hal"ogen.
{/sliders}
Aufgabe: Formuliere die Bildung des Moleküls von Chlorwasser mit Berücksichtigung der HNO-Regel
{slider title="Lösung" open="false" class="icon"}
Wichtig bei Reaktionsgleichungen ist natürlich, dass man immer gleich viel von jeder Atomsorte hat. Dabei darf man die Anzahl frei wählen.
Zur Veranschaulichung auch nochmal eine Abbildung mit den Kugelwolken. Die Summenformel zum Schluss werden im nächsten Kapitel genauer erklärt.
{/sliders}
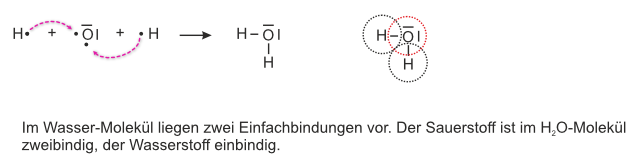
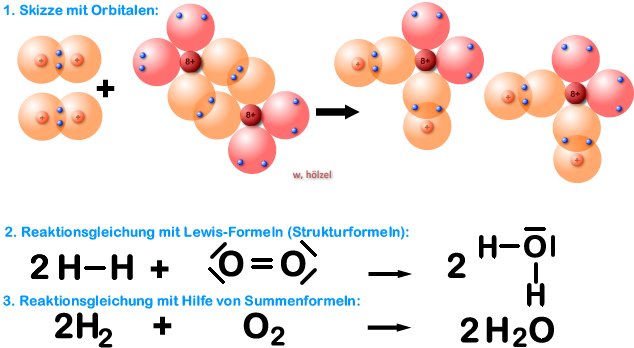
Beispiel 5a: Bildung eines Wassers-Moleküls, H₂O-Molekül - ohne HNO-Regel.
Wasser besteht aus Wasserstoff und Sauerstoff.
Aufgabe: Schreibt zunächst für die Bildung von Wasser aus seinen Elementen Wasserstoff und Sauerstoff die Reaktionsgleichung ohne Berücksichtigung der HNO-Regel:
{slider title="Lösung" open="false" class="icon"}
{/sliders}
Beispiel 5b: Bildung eines Wassers-Moleküls, H₂O-Molekül - mit HNO-Regel.
Aufgabe: Schreibt jetzt die Reaktionsgleichung mit der HNO-Regel. Hinweis: Die Lösung habe ich nochmals zusätzlich mit Kugelwolkenmodell gemacht.
{slider title="Lösung" open="false" class="icon"}
{/sliders}
Beispiel 6a: Bildung eines Ammoniak-Moleküls, NH₃-Molekül - ohne HNO-Regel.
Aufgabe: Zum Schluss der solltet ihr einmal Ammoniak aus seinen beiden Elementen Wasserstoff und Stickstoff herstellen - ohne HNO-Regel. Kleiner Tipp: Euch ist bestimmt schon aufgefallen, dass wann immer ein Einzelelektron (= Punkt in der Lewis-Formel) vorliegt, sich dieses bei den Atombindungen einen Partner sucht und versucht sich zu verbinden. Kontrolliert zum Schluss nochmals, ob die Edelgas-Regel erfüllt ist.
{slider title="Lösung" open="false" class="icon"}
{/sliders}
Beispiel 6b: Bildung eines Ammoniak-Moleküls, NH₃-Molekül - mit HNO-Regel.
Aufgabe: Formuliert die Reaktionsgleichung für die Bildung von Ammoniak in Lewis-Formeln mit Berücksichtigung der HNO-Regel:
{slider title="Lösung" open="false" class="icon"}
Jedes mal zum Ausgleichen die ganzen Strukturformeln hinzuschreiben ist sehr zeitaufwendig (und eigentlich auch unnötig). Man schreibt viel einfacher die Ziffer davor.
{/sliders}
| Zusammenfassung: Eine Atombindung entsteht durch „Überlappung“ zweier (oder mehrerer) einfach besetzter Atomorbitale. Dies ist ein exothermer Vorgang. Die Element-Atome erreichen im Molekül durch gemeinsamen Elektronenbesitz Edelgaskonfiguration. |