4 Anwendungen
4.1 Volta-Element (Voltasche Säule)
(vgl. ABs)
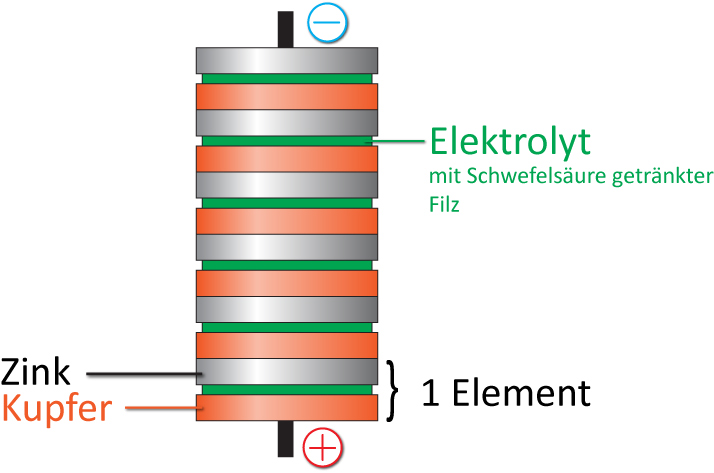
Alessandro Volta entwickelt um 1800 die erste funktionsfähige Batterie, die „Voltasche Säule“, aus Zink- und Kupfer-Platten, zwischen die mit Schwefelsäure getränkter Filz gelegt wurde. Um die Spannung zu erhöhen, stapelte er bis zu 20 Plattenpaare übereinander.
Modellversuch zum Volta-Element
(vgl. AB Schülerübungen)
Versuch a
Gasentwicklung nur an der Zinkelektrode:
Überlege Dir dafür die Reaktionsgleichung:
{slider title="Lösung" open="false" class="icon"}
Zn (s) + 2 H₃O¹⁺ (aq) → Zn²⁺ (aq) + H₂ + 2 H₂O
{/sliders}
Versuch b
An der Phasengrenze Metall/Lösung bilden sich folgende Gleichgewichte aus:
Zn (s) ⇄ Zn²⁺ (aq) + 2 e⁻
Cu (s) ⇄ Cu²⁺ (aq) + 2 e⁻
Die Lösungstendenz der Zinkatome ist größer als die Lösungstendenz der Kupferatome. Die gemessene Spannung ist charakteristisch für die Kombination dieser beiden Redoxpaare.
Versuch c
Bei Stromfluss fließen auf Grund der vorhandenen Spannung Elektronen vom Zink zum Kupfer. Dort werden die Elektronen von den Oxonium-Ionen (Hydronium-Ionen)
Überlegt euch die Halbreaktionen und die gesamte Teilchengleichung:
{slider title="Lösung" open="false" class="icon"}
Oxidation, - Pol Zn → Zn²⁺ (aq) + 2 e⁻
Reduktion, + Pol 2 H₃O¹⁺ (aq) + 2 e⁻ → H₂ + 2 H₂O
Gesamte Teilgleichung: Zn (s) + H₃O¹⁺ (aq) → Zn²⁺ (aq) + H₂ + 2 H₂O
{/sliders}
Vergleich Daniell-Element und Volta-Element
Überlegt euch einmal die Unterschiede beider historischen Galvanischen Zellen:
{slider title="Lösung" open="false" class="icon"}
Im Daniell-Element liegt eine galvanische Zelle aus einer Zink- und einer Kupfer-Halbzelle vor, beim Volta-Element aus einer Zink- und einer Wasserstoff-Halbzelle.
{/sliders}