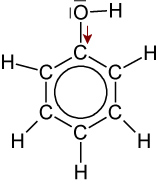
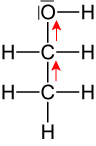
2.6 Phenole = Hydroxybenzole
Vorkommen:
2.6.1 Monohydroxybenzol = Phenol
a) Physikalische Eigenschaften
- Smp.: 40,9; Sdp.: 181,9 °C
- In Wasser nur mäßig löslich (bildet bei ZT eine Emulsion)
- Starkes Zellgift, durch Haut resorbiert
b) Chemische Eigenschaften
- Oxidiert an Luft leicht ⇨ rötliche Färbung
- Karbolsäure“: 2 %ige Säure; Desinfektion
- Im Gegensatz zu Ethanol sauer:
1. Phenol als schwache Säure
pKS = 9,95
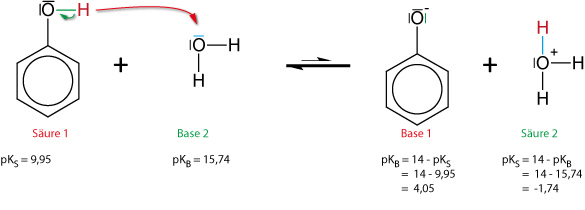
Grenzformeln des Phenolations
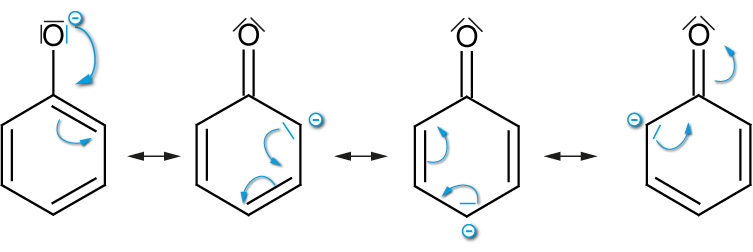
| Phenol | Ethanol | |
| Säurestärke | höher | niedriger |
| Induktiver Effekt |
schwacher -I-Effekt ⇨ elektronenziehend ⇨ H⁺-Abgabe ist erleichtert |
+I-Effekt ⇨ Elektro-nenschiebend |
| Anion: Mesomeriestabilisiert | konjungierte Base (Phenolat): negative Ladung ist über den ganzen Ring delokalisiert ⇨ stabilisiert! | Keine Stabilisierung durch Mesomerien |
| Brønsted-Säure | stärker | schwächer |
| Brønsted-Base | schwächer | stärker |
2.6.3 Synthese
90% der Weltproduktion nach der Hock-Synthese
Wirtschaftliches Verfahren, da auch Aceton nutzbar ist.
siehe Heftaufschrieb
2.6.4 Verwendung
Herstellung von Kunststoffen (Polyamide, Phenoplasten, Phenolharzen und Polycarbonaten)