5.3.4 Primärstruktur = Aminosäuresequenz
= Abfolge der Aminosäuren ⇨ bestimmt die Eigenschaften des Proteinmoleküls.
Frage: Wie viele Kombinationsmöglichkeiten gibt es, wenn ein Protein 129 besitzt?
Antwort: 20¹²⁹
5.3.5 Sekundärstruktur
= H-Brücken führen zu α-Helix oder β-Faltblattstruktur
H-Brücke zwischen dem positivierten H-Atom der Aminogruppe und dem Sauerstoff der Carboxylgruppe der Peptidkette.
α-Helix:
- die AS sind schraubenförmig so aufgerollt, dass die CO - Gruppe der 4. AS der NH - Gruppe der 1. AS benachbart steht.
- rechtsgängig
- innermolekularen H-Brücken
- bevorzugt bei großen Aminosäurereste
- Beispiel α-Keratin der Haare
β-Faltblattstruktur:
- mehrere Peptidketten nebeneinander, wie mehrfach gefaltetes Blatt
- nur bei kleinen Aminosäureresten
- Bsp. Seide
Merke: Die regelmäßige, räumliche Anordnung der Peptidketten, die durch H - Brücken innerhalb einer oder zwischen mehreren Ketten zustande kommt, bezeichnet man als Sekundärstruktur.
Zufallsknäuel
- bei sehr großen Resten, die eine regelhafte Anordnung verhindern
5.3.6 Tertiärstruktur
Räumliche Anordnung eines Proteinmoleküls.
Die Peptidketten werden unter Erhaltung ihrer Sekundärstruktur durch Bindungen die von den Aminosäureresten ausgehen in charakteristischer Weise „verknäuelt“.
- Disulfidbrücken: Atombindungen durch Verknüpfung zweier Cysteinreste
- Wasserstoffbrücken
- Ionenbindungen zwischen funktionellen Resten
- Van-der-Waals-Kräfte zwischen unpolaren Resten
5.3.7 Quartärstruktur
Protein besteht aus mehreren Polypeptidketten; bildet eine Funktionseinheit.
5.3.8 Denaturierung
Zerstörung von Tertiär- bzw. Quartärstruktur durch Störung der Bindungsverhältnisse. Führt häufig zu starker Abnahme der Wasserlöslichkeit, meist irreversibler Prozess.
Faktoren, die zur Änderung der Konformation führen können:
- pH-Wert
- Salzkonzentrationen
- Temperaturen
- Lösungsmittel (polare unpolar) das innere kehrt sich nach außen
- Schwermetalle
- UV-Strahlung
Zerstörung von Tertiär- bzw. Quartärstruktur durch Störung der Bindungsverhältnisse. Führt häufig zu starker Abnahme der Wasserlöslichkeit, meist irreversibler Prozess.
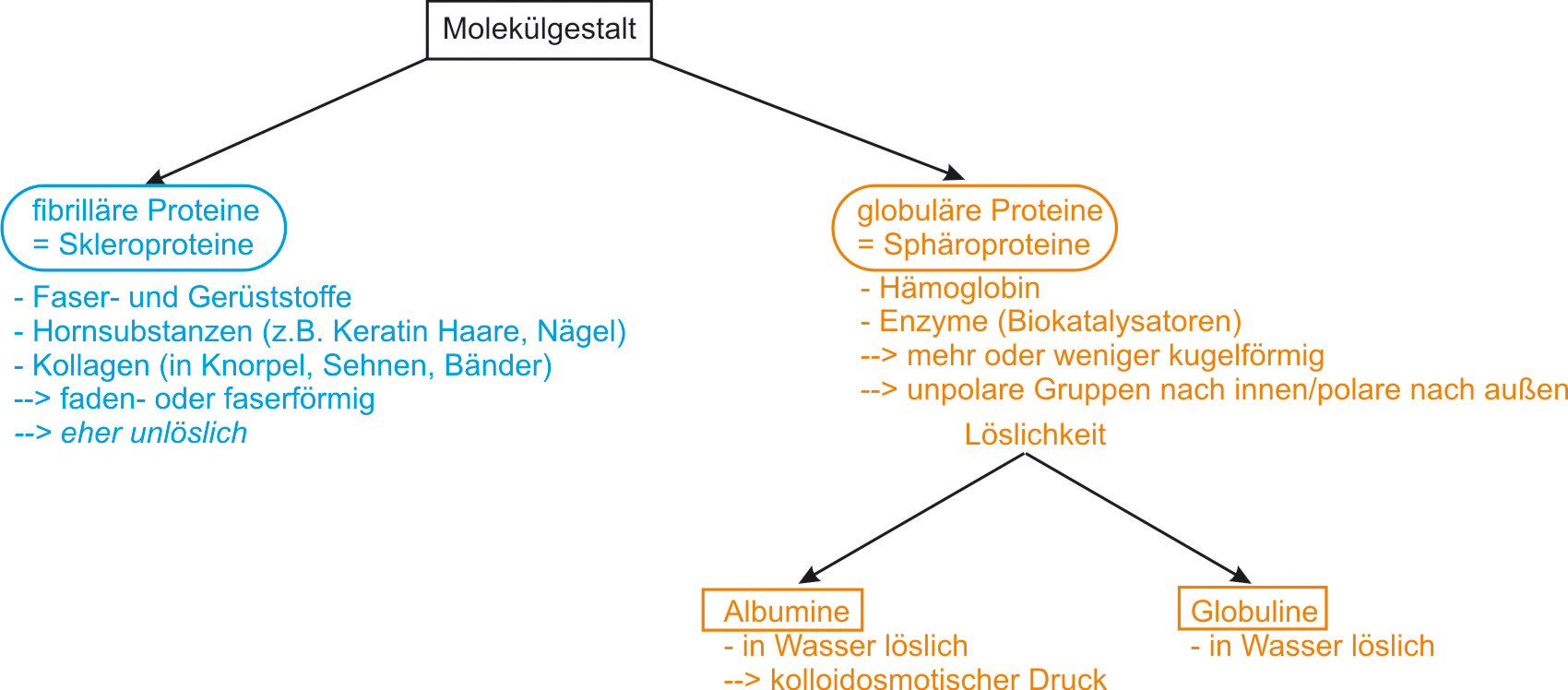
5.3.9 Skleroproteine und Sphäroproteine
5.3.10 Proteide
⇨ Neben Proteinanteile noch andere Gruppen, die nicht aus AS aufgebaut sind. Bsp. Hämoglobin
⇨ Glycoproteide: Nichtproteinanteil = Kohlenhydrat
⇨ Lipoproteide: Nichtproteinanteil = Fettmoleküle
